题目内容
3.将容积为40mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5mL.则原混合气体中NO2和O2体积比可能是( )| A. | 3:7 | B. | 7:1 | C. | 5:3 | D. | 1:1 |
分析 可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,
若剩余气体为氧气,根据4NO2+O2+2H2O=4HNO3,求出参加此反应的O2,最后相加得到原来的氧气;
若为NO,先根据3NO2+H2O=2HNO3+2NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求氧气体积,进而计算NO2的体积,以此解答该题.
解答 解:NO2和O2与水的反应属于循环反应,可简化为:4NO2+O2+2H2O=4HNO3,对该反应来说,若NO2剩余,则实际是NO,由3NO2+H2O=2HNO3+NO可知,剩余NO气体是5mL,说明剩余的NO2为:5mL×3=15mL,其余的25mL气体中V(NO2):V(O2)=4:1,则混合气体中氧气的体积为:25mL×$\frac{1}{5}$=5mL,二氧化氮的体积为:40mL-5mL=35mL,则原混合气体中NO2和O2体积比为:35mL:5mL=7:1;
若剩余气体是O2,则反应的35mL中V(NO2):V(O2)=4:1,原混合气体中二氧化氮的体积为:35mL×$\frac{4}{5}$=28mL,氧气为:40mL-28mL=12mL,
则原混合气体中NO2和O2体积比为:28mL:12mL=7:3,
故选B.
点评 本题考查了氮氧化物的性质、混合物有关计算,为高频考点,题目难度中等,关键是分析剩余气体的成分,再根据反应的方程式计算,试题培养了学生的分析及化学计算能力.

练习册系列答案
相关题目
4.三草酸合铁(Ⅲ)酸钾是制备负载活性催化剂的主要原料.加热至110℃时失去结晶水,230℃时分解.极易感光,室温下光照变为黄色:
2K3[Fe(C2O4)3]•3H2O→2FeC2O4•2H2O+3K2C2O4+2CO2↑+2H2O
已知:
某同学对三草酸合铁(Ⅲ)酸钾的制备及组成进行了实验探究.回答下列问题:
(一)三草酸合铁(Ⅲ)酸钾的制备
(ⅰ)称取4.50g FeC2O4•2H2O固体,加入饱和K2C2O4溶液中,用滴管慢慢加入3% H2O2溶液,不断搅拌,并保持温度在40℃左右.充分反应后,沉淀转化为氧氧化铁.
(ⅱ)加热至沸腾,滴加1mol 的草酸溶液至沉淀溶解.用草酸或草酸钾调节溶液pH=4-5
(ⅲ)小火加热浓缩,冷却结晶,过滤,先用少量冰水洗涤,再用无水乙醇洗涤,低温干燥后称量,得到9.80g 翠绿色晶体.
(1)完成步骤(i)发生反应的离子方程式:
6FeC2O4•2H2O+6 C2O42-+3 H2O2═2Fe(OH)3+4[Fe(C2O4)3]3-+12H2O
(2)步骤(ⅲ)中,用无水乙醇洗涤晶体的目的是.
(3)列式计算本实验中三草酸合铁(Ⅲ)酸钾的产率.
(二)草酸根含量侧定
准确称取4.80g 三草酸合铁(Ⅲ)酸钾样品,配制成250mL 溶液.量取25.00mL 溶液置于锥形瓶中,加入5.0mL 1mol/L H2SO4,用0.06mol/L的KMnO4溶液滴定.滴定终点时消耗KMnO4溶液20.00mL.
(4)滴定过程中,盛放高锰酸钾溶液的仪器名称是酸式滴定管,滴定时发生反应的离子方程式为5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O或5[Fe(C2O4)3]3-+6MnO4-+48H+=30CO2↑+6Mn2++24H2O+5Fe3+.
(5)样品中草酸根的物质的量为0.03mol;若该数值大于4.80g二草酸合铁(Ⅲ)酸钾纯品中草酸根的物质的量,其原因可能是ac(填字母).
a.制取过程中草酸或草酸钾用量过多
b.样品未完全干燥
c.滴定时盛放KMnO4溶液的仪器未用标准液润洗
d.锥形瓶洗净后未烘干
(三)某同学制得的三草酸合铁(Ⅲ)酸钾,晶体表面发黄,推测可能有部分晶体发生了分解.
(6)为了验证此推测是否正确,可选用的试剂是酸化的K3[Fe(CN)6](铁氰化钾)溶液.
2K3[Fe(C2O4)3]•3H2O→2FeC2O4•2H2O+3K2C2O4+2CO2↑+2H2O
已知:
| 物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
| 三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]•3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
| 草酸亚铁 | FeC2O4•2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
(一)三草酸合铁(Ⅲ)酸钾的制备
(ⅰ)称取4.50g FeC2O4•2H2O固体,加入饱和K2C2O4溶液中,用滴管慢慢加入3% H2O2溶液,不断搅拌,并保持温度在40℃左右.充分反应后,沉淀转化为氧氧化铁.
(ⅱ)加热至沸腾,滴加1mol 的草酸溶液至沉淀溶解.用草酸或草酸钾调节溶液pH=4-5
(ⅲ)小火加热浓缩,冷却结晶,过滤,先用少量冰水洗涤,再用无水乙醇洗涤,低温干燥后称量,得到9.80g 翠绿色晶体.
(1)完成步骤(i)发生反应的离子方程式:
6FeC2O4•2H2O+6 C2O42-+3 H2O2═2Fe(OH)3+4[Fe(C2O4)3]3-+12H2O
(2)步骤(ⅲ)中,用无水乙醇洗涤晶体的目的是.
(3)列式计算本实验中三草酸合铁(Ⅲ)酸钾的产率.
(二)草酸根含量侧定
准确称取4.80g 三草酸合铁(Ⅲ)酸钾样品,配制成250mL 溶液.量取25.00mL 溶液置于锥形瓶中,加入5.0mL 1mol/L H2SO4,用0.06mol/L的KMnO4溶液滴定.滴定终点时消耗KMnO4溶液20.00mL.
(4)滴定过程中,盛放高锰酸钾溶液的仪器名称是酸式滴定管,滴定时发生反应的离子方程式为5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O或5[Fe(C2O4)3]3-+6MnO4-+48H+=30CO2↑+6Mn2++24H2O+5Fe3+.
(5)样品中草酸根的物质的量为0.03mol;若该数值大于4.80g二草酸合铁(Ⅲ)酸钾纯品中草酸根的物质的量,其原因可能是ac(填字母).
a.制取过程中草酸或草酸钾用量过多
b.样品未完全干燥
c.滴定时盛放KMnO4溶液的仪器未用标准液润洗
d.锥形瓶洗净后未烘干
(三)某同学制得的三草酸合铁(Ⅲ)酸钾,晶体表面发黄,推测可能有部分晶体发生了分解.
(6)为了验证此推测是否正确,可选用的试剂是酸化的K3[Fe(CN)6](铁氰化钾)溶液.
14.下列过程光能变为电能的是( )
| A. | 镁条燃烧 | B. | 光伏发电 | C. | 光合作用 | D. | 电解冶钠 |
8.下列仪器:①烧杯②坩埚③锥形瓶④蒸发皿⑤试管⑥烧瓶⑦表面皿,用酒精灯加热时,不需要垫石棉网的是( )
| A. | ②④⑤ | B. | ②④⑦ | C. | ④⑥⑦ | D. | ①③⑥ |
15.下列说法正确的是( )
| A. | 电解氯化镁溶液,可制得金属镁 | |
| B. | 测定氢氧化钠是离子化合物时,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| C. | 向FeCl3溶液中加入Mg粉,可观察到有气泡产生 | |
| D. | 在某钠盐溶液中加入澄清石灰水,若有白色沉淀生成,则该钠盐一定是Na2CO3 |
12.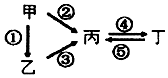 甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )
甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )
 甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )
甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系.下列物质组不满足上述转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | S | H2S | SO3 | H2SO4 |
| C | N2 | NH3 | NO | NO2 |
| D | Si | SiO2 | Na2SiO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
13.一个化学电池的总反应方程式为:Zn+2H+═Zn2++H2↑,该化学电池的组成可能为( )
| A | B | C | D | |
| 正极 | 碳棒 | Cu | Zn | Mg |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | NaCl | HCl |
| A. | A | B. | B | C. | C | D. | D |
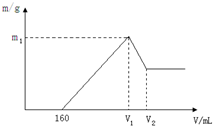 将镁和铝的混合物0.1mol溶于100ml 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答: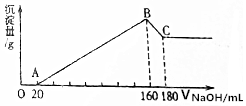 将一定质量的镁、铝合金,投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示.
将一定质量的镁、铝合金,投入200mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加5mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示.