题目内容
11.某固体粉末X中可能含有K2SO4、(NH4)2CO3、K2SO3、NaNO3、Cu2O、FeO、Fe2O3中的若干种.某同学为确定该固体粉末的成分,取X进行如下实验,实验过程及现象如图所示.该同学得出的结论正确的是( )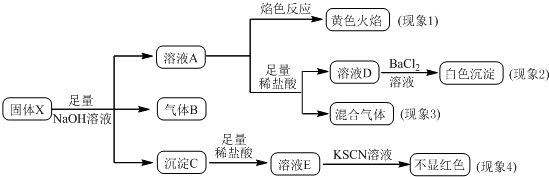
已知:Cu2O+2H+=Cu2++Cu+H2O.
| A. | 根据现象1可推出该固体粉末中一定含有NaNO3 | |
| B. | 根据现象2可推出该固体粉末中一定含有K2SO4 | |
| C. | 根据现象3可推出该固体粉末中一定含有K2SO3 | |
| D. | 根据现象4可推出该固体粉末中一定没有Fe2O3 |
分析 固体加入NaOH生成气体,则应为NH3,即B为NH3,则一定含有(NH4)2CO3,沉淀C加入盐酸后的溶液加入KSCN不先红色,说明溶液中不存在Fe3+,可能有两种情况,一只含有FeO,或Fe2O3和Cu2O都含有Cu2O,生成的Cu与Fe3+发生氧化还原反应而全部溶解,溶液A加入足量稀盐酸生成混合气体,说明不仅仅生成二氧化碳,还应有气体气体,则一定含有K2SO3,与NaNO3发生氧化还原反应生成NO,且K2SO3被氧化,不能确定是否含有K2SO4,以此解答该题.
解答 解:固体加入NaOH生成气体,则应为NH3,即B为NH3,则一定含有(NH4)2CO3,沉淀C加入盐酸后的溶液加入KSCN不先红色,说明溶液中不存在Fe3+,可能有两种情况,一只含有FeO,或Fe2O3和Cu2O都含有Cu2O,生成的Cu与Fe3+发生氧化还原反应而全部溶解,溶液A颜色反应为黄色,因加入氢氧化钠,不能说明含有NaNO3,溶液A加入足量稀盐酸生成混合气体,说明不仅仅生成二氧化碳,还应有气体气体,则一定含有K2SO3,与NaNO3发生氧化还原反应生成NO,且K2SO3被氧化,不能确定是否含有K2SO4,
A.因加入氢氧化钠,不能说明含有NaNO3,故A错误;
B.含有K2SO3,与NaNO3发生氧化还原反应生成NO,且K2SO3被氧化,不能确定是否含有K2SO4,故B错误;
C.由以上分析可知,固体粉末中一定含有K2SO3,故C正确;
D.不能确定是否含有Fe2O3,故D错误.
故选C.
点评 本题考查无机物的推断,为高考常见题型,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断,易错点为B和B,注意体会.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
1. 将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
 将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
将溶液 的c(H+)、c(OH-)之比取为AG[AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$].25℃时,用0.01mol.L-1的氢氧化钠溶液滴定20ml相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )| A. | A点时c(CH3COO-)>c(Na+) | |
| B. | 室温时0.01mol.L-1的醋酸溶液pH=6 | |
| C. | OA段溶液中均有:c(CH3COO-)>c(CH3COOH) | |
| D. | 若B点时加入NaOH溶液40mL,所得溶液中:c(CH3COO-)+2c(CH3COOH)=c(OH-)-c(H+) |
19.下列物质中,属于新型无机非金属材料的是( )
| A. | 钢化玻璃 | B. | 氮化硅陶瓷 | C. | 光导纤维 | D. | 陶瓷 |
6.下列有关实验的说法正确的是( )
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 铝丝先放在NaOH溶液中浸泡1min,取出用蒸馏水冲洗后放在浓硝酸中浸10min,最后放入CuSO4溶液中,铝丝表面无铜析出,说明Al常温下与CuSO4溶液不反应 | |
| C. | 用浓盐酸配制1:1(体积比)的稀盐酸(约6mol/L)通常需要用容量瓶等仪器 | |
| D. | 固体碘单质受热易升华,说明碘单质的热稳定性差 |
3.已知,某无色溶液中含有下列离子中的几种:Na+、Ba2+、Br-、Cl-、SO32-、SO42-,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生.
根据上述实验判断,下列结论正确的是( )
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生.
根据上述实验判断,下列结论正确的是( )
| A. | 原溶液中一定含有Br-、SO42- | |
| B. | 原溶液一定含有Na+,不含Ba2+ | |
| C. | 实验①与上述离子的检验无关,可以省略 | |
| D. | 若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3 |
20.下列物质含氮量最高的是( )
| A. | 硫铵 | B. | 碳铵 | C. | 硝铵 | D. | 尿素 |
20.实验室用需配制250mL0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的Na2CO3溶液
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAFED;
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是将所有碳酸钠移入容量瓶
溶液注入容量瓶前需恢复到室温,这是因为溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏小,配制溶液的浓度偏高;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作偏低;若加蒸馏水时不慎超过了刻度偏低;若定容时俯视刻度线偏高.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面重新配制.
(1)配制250mL0.1mol/L的Na2CO3溶液
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 2.7 | 250mL | 天平、烧杯、玻璃棒、胶头滴管、药匙 |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是将所有碳酸钠移入容量瓶
溶液注入容量瓶前需恢复到室温,这是因为溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏小,配制溶液的浓度偏高;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作偏低;若加蒸馏水时不慎超过了刻度偏低;若定容时俯视刻度线偏高.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面重新配制.
 .
.