题目内容
6.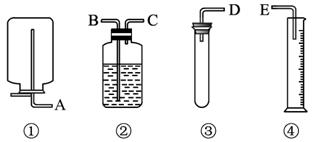 现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,
现有药品和如图装置:质量为wg的锌片、稀H2SO4、无水硫酸铜和蒸馏水,设计一个简单的实验,测定Zn的相对原子质量(气体体积均可认为是在标准状况下测定)参见如图
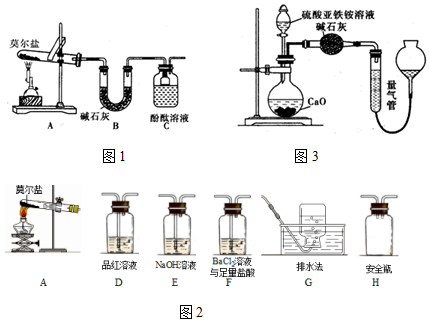
(1)应选用的装置的连接顺序是(填接口字母)DCBE.
(2)操作中,怎样加放试剂以保证不漏出氢气连接好装置后,打开③的活塞,加入适量的稀硫酸,将试管倾斜一定角度,将锌片放在试管壁上,塞好塞子,缓慢竖起试管将锌片滑入硫酸中,使反应开始.
(3)以下是测量收集气体体积必须包括的几个步骤,则这三步操作的正确顺序是②①③
①调整量筒内外液面调试使之相同
②使试管和量筒内气体都冷却至室温
③读取量筒内气体的体积.
(4)若④中收集到水VmL(锌片反应完全),则锌的相对原子质量的数学表达式为$\frac{22400w}{V}$.
(5)由于锌片可能含不溶性杂质,实验测得的锌的相对原子质量可能比真实值偏高(填“偏高”或“偏低”).
分析 通过所提供的药品和仪器可知,实验原理为:将稀硫酸与锌片在③中充分反应,产生的氢气从D通入C,通过B将集气瓶中的水排入量筒中,通过测量排出的水的量来得知产生氢气的量,
(1)根据实验原理来分析仪器的连接顺序;
(2)保证不漏出氢气即保证在塞紧活塞前不让锌和硫酸接触;
(3)从气体的热胀冷缩和读量筒中气体体积的方法两方面进行分析;
(4)根据提供的数据可知产生的氢气的量,再根据相对原子质量在数值上等于摩尔质量,而摩尔质量M=$\frac{m}{n}$来计算;
(5)根据摩尔质量M=$\frac{m}{n}$,通过分析各种操作失误对所测量的氢气体积的影响来分析.
解答 解:(1)将稀硫酸与锌片在③中充分反应,产生的氢气从D通入C,通过B将集气瓶中的水排入量筒中,通过测量排出的水的量来得知产生氢气的量,故装置的连接顺序为:DCBE,
故答案为:DCBE;
(2)操作中,要保证不漏出氢气,则在塞紧活塞前不让锌和硫酸接触,具体操作为:连接好装置后,打开③的活塞,加入适量的稀硫酸,将试管倾斜一定角度,将锌片放在试管壁上,塞好塞子,缓慢竖起试管将锌片滑入硫酸中,使反应开始,
故答案为:连接好装置后,打开③的活塞,加入适量的稀硫酸,将试管倾斜一定角度,将锌片放在试管壁上,塞好塞子,缓慢竖起试管将锌片滑入硫酸中,使反应开始;
(3)要准确测量气体体积必须保持量筒内外气体的温度和压强相等,因此在读取量筒内气体的体积之前,应使试管和量筒内的气体都冷却至室温;再调节量筒内外液面高度使之相同,所以正确的顺序为:②①③;
故答案为:②①③;
(4)根据提供的数据可知产生的氢气的量为VmL,即生成的氢气的物质的量n=$\frac{V×1{0}^{-3}L}{22.4L/mol}$=$\frac{V}{22400}$mol,而根据反应可知,1mol锌~1mol氢气,故反应掉的锌的物质的量n=$\frac{V}{22400}$mol,由于相对原子质量在数值上等于摩尔质量,而锌的摩尔质量M=$\frac{m}{n}$=$\frac{wg}{\frac{V}{22400}mol}$=$\frac{22400w}{V}$g/mol,故锌的相对原子质量为$\frac{22400w}{V}$,
故答案为:$\frac{22400w}{V}$;
(5)由于摩尔质量M=$\frac{m}{n}$=$\frac{22400w}{V}$g/mol,假如锌片含不与酸反应的杂质,则测得生成的氢气的体积v偏小,则M偏高;若气密性不好,则测得生成的氢气的体积v偏小,则M偏高,
故答案为:偏高.
点评 本题考查了排气量气装置,要注意的是锌和硫酸的反应,注意根据公式来分析误差,综合性较强,题目难度中等.

 53随堂测系列答案
53随堂测系列答案| A. | Al 1s22s22p63s23p1 | B. | S2- 1s22s22p63s23p6 | ||
| C. | Cu[Ar]3d94s2 | D. | Ca[Ar]4s2 |
| A. | 9.0L | B. | 13.44L | C. | 17.92L | D. | 16.8L |
| A. | +184.6 kJ/mol | B. | -92.3 kJ/mol | C. | -369.2 kJ/mol | D. | +92.3 kJ/mol |
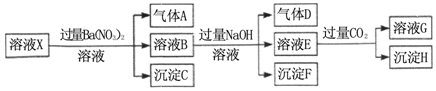
| A. | 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42- | |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- | |
| C. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| D. | 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06mol•L-1 |
| A. | n(H2)═a mol | B. | n(H2)═1 mol | ||
| C. | a mol<n(H2)<1 mol | D. | 1 mol<n(H2)<4 mol |
| A. | 着力开发风能、太阳能、地热能等清洁高效新能源,减少煤、石油等化石燃料的使用 | |
| B. | 为了减少SO2和NOx的排放,工业废气排放到大气之前必须回收处理 | |
| C. | 大力开采煤、石油和天然气,以满足经济发展和日常生活的需要 | |
| D. | 大力发展混合动力汽车、电动汽车等新能源汽车,以减少对化石能源的依赖,保护城乡环境,关爱人类生存空间 |