题目内容
16.下列关于热化学反应的描述中正确的是( )| A. | 反应物的总能量低于生成物的总能量时,发生放热反应 | |
| B. | HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ba(OH)2的反应热△H=2×(-57.3)KJ/mol | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
分析 A.当反应物总能量大于生成物总能量时,反应放热,反之吸热;
B.H2SO4和Ba(OH)2反应生成硫酸钙沉淀,不仅仅生成水;
C.反应的热效应只与始态、终态有关,与过程无关;
D.硫蒸汽所含能量高,放出热量多.
解答 解:A.当反应物总能量大于生成物总能量时,反应放热,反之吸热,所以反应物的总能量低于生成物的总能量时,发生吸热反应,故A错误;
B.H2SO4和Ba(OH)2反应生成硫酸钡沉淀,不仅仅生成水,放出更多的热量,则H2SO4和Ba(OH)2反应的中和热△H<2×(-57.3)kJ/mol,故B错误;
C.反应的热效应只与始态、终态有关,与过程无关,所以同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同,故C正确;
D.硫蒸汽所含能量比硫固体多,定量燃烧时,硫蒸汽放热多,故D错误.
故选C.
点评 本题综合考查了反应热和焓变的内涵和外延,为高频考点,侧重于双基的理解和运用的考查,难度不大,注意准确把握相关概念,学习中注意相关基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.目前国际空间站处理CO2废气涉及的反应为CO2+4H2$\stackrel{钌催化剂}{?}$ CH4+2H2O.该反应的下列说法正确的是( )
| A. | 钌催化剂能加快该反应的速率 | |
| B. | 升高温度能加快该反应的速率 | |
| C. | 当达到一定限度时,CO2能100%转化为CH4 | |
| D. | 当达到一定限度时,反应速率:v(正)=v(逆)=0,反应停止 |
7.将一定量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体a mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器中仍剩有铜粉m2g,则(m1-m2)为( )
| A. | $\frac{9a}{700}$ | B. | $\frac{3a}{700}$ | ||
| C. | 0 | D. | 缺少条件,无法计算 |
4.下列互为同位素的是( )
| A. | Na 和 Na+ | B. | H2和 D2 | C. | 16O 和 18O | D. | CO 和 CO2 |
11.下列各基态原子或离子的电子排布式错误的是( )
| A. | Al 1s22s22p63s23p1 | B. | S2- 1s22s22p63s23p6 | ||
| C. | Cu[Ar]3d94s2 | D. | Ca[Ar]4s2 |
1.下列物质的分类合理的是( )
| A. | 酸性氧化物:CO2、SiO2、SO2、NO2 | |
| B. | 碱:NaOH、KOH、Ba(OH)2、纯碱 | |
| C. | 混合物:盐酸 漂白粉 水煤气 氢氧化铁胶体 | |
| D. | 碱性氧化物:Na2O2、CaO、MgO、Al2O3 |
8.下列关于卤族元素(X)及其化合物叙述错误的是( )
| A. | 单质均有颜色,随原子序数递增颜色加深 | |
| B. | HX随原子序数递增稳定性逐渐减弱 | |
| C. | 单质(除F2)均能与水反应形成HX和HXO,HXO的结构式为:H-X-O | |
| D. | HX中除HF分子间存在氢键,其余HX分子均不存在氢键 |
5.某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做如下探究实验.

已知:①无水氯化铁在空气中易潮解,加热易升华;②工业上,向500-600℃的铁屑中通入氯气和生产无水氯化铁;③向炽热的铁屑中通入氯化氢可以生成无水氯化亚铁和氢气.
(1)仪器N的名称是分液漏斗,N中盛有浓盐酸,烧瓶M中的固体试剂KMnO4(或KClO3)(填化学式).
(2)装置的连接顺序为a→g→h→d→e→b→c→d→e→f.(用小写字母表示,部分装置可重复使用)
(3)若缺少装置E、则对本实验造成的影响是HCl和Fe反应生成的H2与Cl2混合受热发生爆炸,且有杂质氯化亚铁生成;请简述检验产物是否受影响的方法及实验现象:取少量产物于一洁净的试管种加少量水将产物溶解,向其中滴加铁氰化钾溶液,若产生蓝色沉淀,则证明存在氯化亚铁.
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氧剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中发生反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
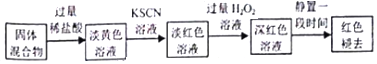
①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是2Fe2++2H++H2O2=2F3++2H2O(用离子方程式表示).
②已知红色褪去的同时有气体产生,经检验气体为O2,该小组对红色褪去的原因进行探究.
由实验Ⅰ和Ⅱ可得出的结论为H2O2将SCN-氧化成SO42-.

已知:①无水氯化铁在空气中易潮解,加热易升华;②工业上,向500-600℃的铁屑中通入氯气和生产无水氯化铁;③向炽热的铁屑中通入氯化氢可以生成无水氯化亚铁和氢气.
(1)仪器N的名称是分液漏斗,N中盛有浓盐酸,烧瓶M中的固体试剂KMnO4(或KClO3)(填化学式).
(2)装置的连接顺序为a→g→h→d→e→b→c→d→e→f.(用小写字母表示,部分装置可重复使用)
(3)若缺少装置E、则对本实验造成的影响是HCl和Fe反应生成的H2与Cl2混合受热发生爆炸,且有杂质氯化亚铁生成;请简述检验产物是否受影响的方法及实验现象:取少量产物于一洁净的试管种加少量水将产物溶解,向其中滴加铁氰化钾溶液,若产生蓝色沉淀,则证明存在氯化亚铁.
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氧剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中发生反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是2Fe2++2H++H2O2=2F3++2H2O(用离子方程式表示).
②已知红色褪去的同时有气体产生,经检验气体为O2,该小组对红色褪去的原因进行探究.
| 实验 | 操作 | 现象 | |
| 实验Ⅰ (取褪色后溶液3等份) | 第1份 | 滴加FeCl2溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴加稀盐酸和BaCl2溶液 | 产生白色沉淀 | |
| 实验Ⅱ (取与褪色后的溶液同浓度的FeCl3溶液) | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |