题目内容
为测定某有机化合物A的结构,进行如下实验.
【分子式的确定】(1)将有机物A置于氧气流中充分燃烧,实验
测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下).则该物质中各元素的原子个数比是 ;
(2)质谱仪测定有机化合物的相对分子质量为46,则该物质的分子式是 ;
(3)根据价键理论,预测A的可能结构并写出结构简式 .
【结构式的确定】(4)经测定,有机物A分子内有3种氢原子,则A的结构简式为 .
【性质实验】(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式: .
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式: .
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香.请写出最后一步反应的化学方程式: .
【分子式的确定】(1)将有机物A置于氧气流中充分燃烧,实验
测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下).则该物质中各元素的原子个数比是
(2)质谱仪测定有机化合物的相对分子质量为46,则该物质的分子式是
(3)根据价键理论,预测A的可能结构并写出结构简式
【结构式的确定】(4)经测定,有机物A分子内有3种氢原子,则A的结构简式为
【性质实验】(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式:
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:
(7)A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香.请写出最后一步反应的化学方程式:
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)根据元素守恒可判断有机化合物中一定含有C和H两种元素,根据生成8.8g的二氧化碳中C元素质量即为化合物中所含C元素质量、生成5.4g 的水中H元素质量即为化合物中所含H元素质量,对氧元素的确定要根据二氧化碳和水中的氧元素质量之和与氧气中氧元素的质量来分析,若前者大,则有机化合物有氧元素,两者相等,则有机化合物没有有氧元素,然后求出各自的物质的量,计算该物质中各元素的原子个数比;
(2)根据有机物的最简式和相对分子质量求出分子式;
(3)根据分子式结合同分异构现象写出结构简式;
(4)根据分子式结合氢原子种类写出结构简式;
(5)乙醇在浓硫酸加热的条件下反应可以得到乙烯;
(6)加成反应的原子利用率是100%,依稀可以和HX发生加成反应;
(7)粮食酿酒的过程包括乙醇和乙酸反应生成乙酸乙酯的过程.
(2)根据有机物的最简式和相对分子质量求出分子式;
(3)根据分子式结合同分异构现象写出结构简式;
(4)根据分子式结合氢原子种类写出结构简式;
(5)乙醇在浓硫酸加热的条件下反应可以得到乙烯;
(6)加成反应的原子利用率是100%,依稀可以和HX发生加成反应;
(7)粮食酿酒的过程包括乙醇和乙酸反应生成乙酸乙酯的过程.
解答:
解:(1)n(CO2)=
=0.2 mol,
n(H2O)=
=0.3 mol,反应中消耗O2的物质的量n(O2)=
=0.3 mol,
则有机物中氧原子物质的量 n(O)=0.2 mol×2+0.3 mol×1-0.3 mol×2=0.1 mol,所
以该物质中C、H、O原子的个数比为0.2 mol:(0.3 mol×2):0.1 mol=2:6:1.
故答案为:2:6:1;
(2)因其相对分子质量为46,则其分子式为C2H6O,故答案为:C2H6O;
(3)据价键理论,可预测C2H6O的可能结构简式为CH3CH2OH、CH3OCH3,故答案为:CH3CH2OH、CH3OCH3;
(4)据A分子内有3种氢原子,所以其结构简式为CH3CH2OH,故答案为:CH3CH2OH;
(5)乙醇在一定条件下脱水可生成乙烯,乙烯可合成包装塑料聚乙烯,反应为:CH3CH2OH
CH2=CH2↑+H2O,故答案为:CH3CH2OH
CH2=CH2↑+H2O;
(6)用乙烯制备氯乙烷的原理:CH2=CH2+HCl
CH3CH2Cl,故答案为:CH2=CH2+HCl
CH3CH2Cl;
(7)乙醇可通过粮食在一定条件下制得,由粮食制得的乙醇在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香,是生成乙酸乙酯的缘故请反应的化学方程式:CH3CH2OH+CH3COOH
CH3COOC2H5+H2O,故答案为:CH3CH2OH+CH3COOH
CH3COOC2H5+H2O.
| 8.8g |
| 44g/mol |
n(H2O)=
| 5.4g |
| 18g/mol |
| 6.72L |
| 22.4L/mol |
则有机物中氧原子物质的量 n(O)=0.2 mol×2+0.3 mol×1-0.3 mol×2=0.1 mol,所
以该物质中C、H、O原子的个数比为0.2 mol:(0.3 mol×2):0.1 mol=2:6:1.
故答案为:2:6:1;
(2)因其相对分子质量为46,则其分子式为C2H6O,故答案为:C2H6O;
(3)据价键理论,可预测C2H6O的可能结构简式为CH3CH2OH、CH3OCH3,故答案为:CH3CH2OH、CH3OCH3;
(4)据A分子内有3种氢原子,所以其结构简式为CH3CH2OH,故答案为:CH3CH2OH;
(5)乙醇在一定条件下脱水可生成乙烯,乙烯可合成包装塑料聚乙烯,反应为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
(6)用乙烯制备氯乙烷的原理:CH2=CH2+HCl
| △ |
| 催化剂 |
| △ |
| 催化剂 |
(7)乙醇可通过粮食在一定条件下制得,由粮食制得的乙醇在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香,是生成乙酸乙酯的缘故请反应的化学方程式:CH3CH2OH+CH3COOH
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
点评:本题主要考查了分子式的确定和分子结构的确定,有一定的难度,注意物质的性质以及分子式的确定方法是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
工业上用洗净的废铜作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采取的方法是( )
A、Cu
| |||||
B、Cu
| |||||
C、Cu
| |||||
D、Cu
|
下列不属于蛋白质变性的是( )
| A、打针前用酒精消毒 |
| B、蛋白质溶液加入食盐变混浊 |
| C、用稀福尔马林浸泡种子 |
| D、用波尔多液(含硫酸铜)防止作物虫害 |
已知Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2═2CuO+4NO2↑+O2↑,将少量Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,下列说法正确的是( )
| A、NO2能支持燃烧 |
| B、NO2不能支持燃烧 |
| C、木条复燃是因为硝酸铜分解产生了氧气的缘故 |
| D、木条复燃是因为硝酸铜分解产生了氧气和二氧化氮共同作用的结果 |
在 1L K2SO4、CuSO4的混合溶液中,c(SO42-)=2mol?L-1,用石墨作电极电解此溶液,当通电一段时间后(电解完全),两极均收集到22.4L气体(标准状况),原溶液中c(K+)为( )
| A、0.5 mol?L-1 |
| B、1 mol?L-1 |
| C、1.5 mol?L-1 |
| D、2 mol?L-1 |
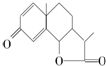 是一种驱虫药--山道年的结构简式,试确定其分子式为
是一种驱虫药--山道年的结构简式,试确定其分子式为