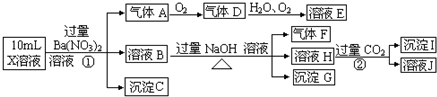
题目内容
26gSi02和CaCO3的混合物,在高温条件下完全反应,最后固体质量为17.2g.
(1)写出相关的化学方程式.
(2)求生成的气体的体积.
(3)求混合物中Si02的质量.
(1)写出相关的化学方程式.
(2)求生成的气体的体积.
(3)求混合物中Si02的质量.
考点:有关混合物反应的计算
专题:计算题
分析:(1)碳酸钙与二氧化硅反应生成硅酸钙与二氧化碳,若碳酸钙过量,则碳酸钙分解为氧化钙与二氧化碳;
(2)混合物中碳元素完全转化到二氧化碳中,质量减少为生成二氧化碳的质量,根据n=
计算二氧化碳物质的量,再根据V=nVm计算其体积;
(3)根据碳元素守恒计算碳酸钙的质量,进而计算二氧化硅的质量.
(2)混合物中碳元素完全转化到二氧化碳中,质量减少为生成二氧化碳的质量,根据n=
| m |
| M |
(3)根据碳元素守恒计算碳酸钙的质量,进而计算二氧化硅的质量.
解答:
解:(1)碳酸钙与二氧化硅反应生成硅酸钙与二氧化碳,若碳酸钙过量,则碳酸钙分解为氧化钙与二氧化碳,可能发生的反应为:CaCO3+SiO2
CaSiO3+CO2↑,CaCO3
CaO+CO2↑,
答:可能发生的反应有:CaCO3+SiO2
CaSiO3+CO2↑,CaCO3
CaO+CO2↑;
(2)由方程式可知,混合物中碳元素完全转化到二氧化碳中,质量减少为生成二氧化碳的质量,故二氧化碳物质的量为:
=0.2mol,标况下二氧化碳的体积为:0.2mol×22.4L/mol=4.48L,
答:生成气体在标况下的体积为4.48L;
(3)根据碳元素守恒,可知n(CaCO3)=n(CO2)=0.2mol,故m(CaCO3)=0.2mol×100g/mol=20g,
故混合物中SiO2的质量为:26.0g-20g=6.0g,
答:原混合物中SiO2的质量为6.0g.
| ||
| ||
答:可能发生的反应有:CaCO3+SiO2
| ||
| ||
(2)由方程式可知,混合物中碳元素完全转化到二氧化碳中,质量减少为生成二氧化碳的质量,故二氧化碳物质的量为:
| 26g-17.2g |
| 44g/mol |
答:生成气体在标况下的体积为4.48L;
(3)根据碳元素守恒,可知n(CaCO3)=n(CO2)=0.2mol,故m(CaCO3)=0.2mol×100g/mol=20g,
故混合物中SiO2的质量为:26.0g-20g=6.0g,
答:原混合物中SiO2的质量为6.0g.
点评:本题考查有关混合物反应的计算,题目难度中等,根据方程式判断固体质量减少为生成二氧化碳的质量为解答关键,注意掌握有关混合物反应的化学计算方法,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
已知苯和一卤代烷在催化剂的作用下可生成苯的同系物: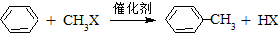 在催化剂的作用下,由苯和下列各组物质合成乙苯,最好应选用的是( )
在催化剂的作用下,由苯和下列各组物质合成乙苯,最好应选用的是( )
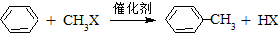 在催化剂的作用下,由苯和下列各组物质合成乙苯,最好应选用的是( )
在催化剂的作用下,由苯和下列各组物质合成乙苯,最好应选用的是( )| A、CH3CH3和Cl |
| B、CH2=CH2和Cl2 |
| C、CH2=CH2和HCl |
| D、CH3CH3和HCl |
将等物质的量的甲烷与氯气在光照条件下反应,得到的产物最多的是( )
| A、HCl |
| B、CH2Cl2 |
| C、CH3Cl |
| D、CCl4 |
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
| B、标准状况下,11.2 L H2O 所含的分子数为0.5NA |
| C、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| D、18g H2O 和H2O2 的混合物含有的分子数为1NA |