题目内容
下列离子方程式书写正确的是( )
| A、少量CO2通入Ba(OH)2溶液中:CO2+2OH-═CO32-+H2O |
| B、NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++Al3++2SO42-+2Ba2++4OH-═NH3?H2O+Al(OH)3↓+2BaSO4↓ |
| C、FeCl3溶液腐蚀铜线路板:Fe3++Cu═Fe2++Cu2+ |
| D、向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3-+OH-═CO32-+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.氢氧化钡溶液与二氧化碳反应生成碳酸钡沉淀;
B.硫酸根离子恰好反应,NH4Al(SO4)2与Ba(OH)2的物质的量之比为1:2,铵根离子结合氢氧根离子能力强于氢氧化铝,反应生成一水合氨和氢氧化铝沉淀;
C.根据电荷守恒判断,该离子方程式两边电荷不守恒;
D.氢氧化钙少量,按照氢氧化钙的组成书写离子方程式.
B.硫酸根离子恰好反应,NH4Al(SO4)2与Ba(OH)2的物质的量之比为1:2,铵根离子结合氢氧根离子能力强于氢氧化铝,反应生成一水合氨和氢氧化铝沉淀;
C.根据电荷守恒判断,该离子方程式两边电荷不守恒;
D.氢氧化钙少量,按照氢氧化钙的组成书写离子方程式.
解答:
解:A.少量CO2通入Ba(OH)2溶液中,反应生成碳酸钡沉淀,正确的离子方程式为:CO2+Ba2++2OH-═H2O+BaCO3↓,故A错误;
B.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全,NH4Al(SO4)2与Ba(OH)2的物质的量之比为1:2,铵根离子结合氢氧根离子能力强于氢氧化铝,反应生成NH3?H2O、Al(OH)3沉淀,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-═NH3?H2O+Al(OH)3↓+2BaSO4↓,故B正确;
C.铁离子与铜反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.NaHCO3溶液中滴入少量Ca(OH)2溶液,反应生成了碳酸钙沉淀、碳酸根离子,正确的离子方程式为:2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O,故D错误;
故选B.
B.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全,NH4Al(SO4)2与Ba(OH)2的物质的量之比为1:2,铵根离子结合氢氧根离子能力强于氢氧化铝,反应生成NH3?H2O、Al(OH)3沉淀,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-═NH3?H2O+Al(OH)3↓+2BaSO4↓,故B正确;
C.铁离子与铜反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.NaHCO3溶液中滴入少量Ca(OH)2溶液,反应生成了碳酸钙沉淀、碳酸根离子,正确的离子方程式为:2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O,故D错误;
故选B.
点评:本题考查了离子方程式的正误判断,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
据下表信息,判断以下叙述正确的是( )
| 部分短周期元素的原子半径及主要化合价 | ||||||
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
| A、GOH溶液和M(OH)3可以相互反应 |
| B、非金属性:T<Q |
| C、气态氢化物的稳定性:R>T |
| D、L2+与T2-核外电子数相等 |
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是( )
| A、甲苯的硝化反应生成三硝基甲苯 |
| B、甲苯能使酸性高锰酸钾溶液褪色 |
| C、甲苯燃烧产生带浓烟的火焰 |
| D、1mol甲苯与3mol H2发生加成反应 |
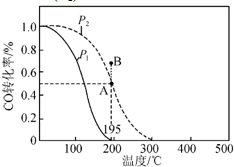 在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g);△H.测得CO的转化率随温度及不同压强下CO的变化如图所示,P2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )
在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g);△H.测得CO的转化率随温度及不同压强下CO的变化如图所示,P2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )P2及195℃n(H2)随时间变化
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A、P1<P2,△H<0 |
| B、0~3 min,平均速率v(CH3OH)=0.8 mol?L-1?min-1 |
| C、在P2及195℃时,该反应的平衡常数为25 L2?mol-2 |
| D、在B点时,v(正)>v(逆) |
下列有关物质的性质和该性质的应用均正确的是( )
| A、SiO2具有较好的导电性,可用于制造半导体材料 |
| B、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹 |
将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池.燃料电池的基本组成为电极、电解质、燃料和氧化剂.此种电池能量利用率可高达80(一般柴油发电机只有40%左右),产物污染也少.下列有关燃料电池说法错误的是( )
| A、上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 |
| B、氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 |
| C、乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-═2CO2↑+3H2O |
| D、KOH作电解质的甲烷燃料电池的正极反应为O2+2H2O+4e-═4OH- |
下列说法正确的是( )
| A、流水、风力是一次能源,电力、蒸汽是二次能源 |
| B、普通锌锰电池是一次电池,碱性锌锰电池是二次电池 |
| C、同周期元素形成的简单离子中,原子序数越大的离子半径越小 |
| D、原子核外电子层数越多,原子半径一定越大 |
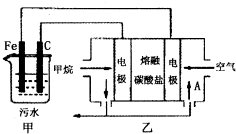 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 |
| B、甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C、为了增加污水的导电能力,应向污水中如入适量的H2SO4溶液 |
| D、当乙装置中有1.6g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48L |