题目内容
2.等体积、物质的量浓度之比为6:2:3的AClx、BCly、CClz三种盐溶液分别与足量AgNO3溶液反应,生成等量沉淀,则x:y:z为( )| A. | 1:2:3 | B. | 1:3:2 | C. | 2:4:5 | D. | 2:3:1 |
分析 发生反应Ag++Cl-=AgCl↓,AClx、BCly、CClz三种盐溶液分别与足量AgNO3溶液反应,生成等量沉淀,说明氯化银的物质的量相等,所以氯离子的物质的量相等,则等体积的溶液中得到:6x=2y=3z,由此分析解答.
解答 解:发生反应Ag++Cl-=AgCl↓,AClx、BCly、CClz三种盐溶液分别与足量AgNO3溶液反应,生成等量沉淀,说明氯化银的物质的量相等,所以氯离子的物质的量相等,则等体积的溶液中得到:6x=2y=3z,所以x:y:z为1:3:2,故选B.
点评 本题考查离子方程式的有关计算、物质的量浓度的计算,难度不大,清楚发生的离子反应是解题关键,注意利用假设法进行的计算,可以简化计算.

练习册系列答案
相关题目
13.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>HI | B. | 沸点:H2O<H2S<H2Se | ||
| C. | 酸性:HClO4>H2SO4. | D. | 离子半径:N3->O2->F- |
10.2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注.${\;}_{92}^{235}$U是一种重要的核燃料,这里的“235”是指该原子的( )
| A. | 质子数 | B. | 中子数 | C. | 质量数 | D. | 电子数 |
17.下列离子方程式改写成化学方程式,正确的是( )
| A. | Cu2++2OH-→Cu(OH)2↓ 3CuSO4+2Fe(OH)3→Fe2(SO4)3+3Cu(OH)2↓ | |
| B. | S2-+2Ag+→Ag2S↓ H2S+2AgNO3→Ag2S↓+2HNO3 | |
| C. | CO32-+2H+→H2O+CO2↑ Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑ | |
| D. | Ag++Cl-=AgCl↓ AgNO3+NaCl=NaNO3+AgCl↓ |
14.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 碳酸氢钠是焙制糕点的发酵粉的一种成分 | |
| B. | CO、NO、NO2都是大气污染物,在空气中都能稳定存在 | |
| C. | 光导纤维和玻璃都是硅酸盐产品 | |
| D. | 明矾能作净水剂,因为它能与水反应生成强氧化性的氢氧化铝胶体 |
11.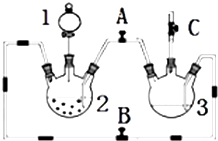 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
(1)稀硫酸应放在分液漏斗中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关B、打开开关AC就可观察到氢氧化亚铁的颜色为白色.试分析实验开始时排尽装置中空气的理由防止生成的氢氧化亚铁被氧化.
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是将铁粉换成铁块或铁钉.
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4•FeSO4•6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
滴定过程中发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.滴定终点的现象是最后一滴滴入,溶液由无色变为浅紫色,且30s不变色.
通过实验数据计算的该产品纯度为$\frac{980c}{a}$×100%(用字母ac表示).表中第一次实验中记录数据明显大于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.(1)稀硫酸应放在分液漏斗中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关B、打开开关AC就可观察到氢氧化亚铁的颜色为白色.试分析实验开始时排尽装置中空气的理由防止生成的氢氧化亚铁被氧化.
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是将铁粉换成铁块或铁钉.
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4•FeSO4•6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
通过实验数据计算的该产品纯度为$\frac{980c}{a}$×100%(用字母ac表示).表中第一次实验中记录数据明显大于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
12.关于下列物质的用途的说法错误的是( )
| A. | 部分卤代烃可用作灭火剂 | |
| B. | 甲醛的水溶液(福尔马林)可用于防腐 | |
| C. | 酚类化合物有毒,不能用于杀菌消毒 | |
| D. | 乙二醇可用于配制汽车防冻液 |