题目内容
11.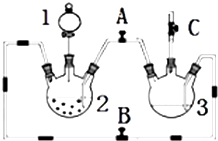 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.(1)稀硫酸应放在分液漏斗中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关B、打开开关AC就可观察到氢氧化亚铁的颜色为白色.试分析实验开始时排尽装置中空气的理由防止生成的氢氧化亚铁被氧化.
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是将铁粉换成铁块或铁钉.
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4•FeSO4•6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.
①为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
通过实验数据计算的该产品纯度为$\frac{980c}{a}$×100%(用字母ac表示).表中第一次实验中记录数据明显大于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
分析 用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液,结合装置分析可知,开启BC,关闭A,需要在三颈瓶2中加入铁单质,分液漏斗中是稀硫酸,利用反应生成氢气排净装置中的空气,可以收集C处的气体检验是否是纯净的氢气,将仪器中的空气排尽后,然后关闭B,开启AC,利用生成的氢气在装置2中压强增大,把硫酸亚铁溶液压入装置3的氢氧化钠溶液中,反应生成白色氢氧化亚铁白色沉淀,可观察到氢氧化亚铁的颜色为白色沉淀,
(1)分析可知分液漏斗中为稀硫酸,和装置2中的铁反应生成硫酸亚铁和氢气;
(2)结合装置分析可知,开启BC,关闭A,需要在三颈瓶2中加入铁单质,分液漏斗中是稀硫酸,利用反应生成氢气排净装置中的空气,可以收集C处的气体检验是否是纯净的氢气,将仪器中的空气排尽后,然后关闭B,开启AC,利用生成的氢气在装置2中压强增大,把硫酸亚铁溶液压入装置3的氢氧化钠溶液中,反应生成白色氢氧化亚铁白色沉淀,防止生成的氢氧化亚铁被空气中的氧气氧化;
(3)将铁粉换成铁块或铁钉,可以防止仪器2中铁粉通过导管进入仪器3中;
(4)①依据该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇分析,洗涤不能溶解产品,不能引入新的杂质;
②称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定,发生的反应为高锰酸钾溶液氧化亚铁离子为铁离子;
反应终点的判断可以利用高锰酸钾溶液的紫红色判断,滴入最后一滴溶液变化为紫红色,半分钟内不变,证明反应达到终点;
依据反应的定量关系计算亚铁离子物质的量,得到(NH4)2SO4•FeSO4•6H2O的质量,计算纯度,高锰酸钾溶液的体积第一次误差较大,应舍去;
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积,液面被提高,读取体积减小;
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡测定溶液体积增大;
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,待装液润洗会增多消耗高锰酸钾溶液的体积,测定结果增大;
D.三次使用的高锰酸钾都是一样的,消耗的高锰酸钾体积应是相同的.
解答 解:(1)此实验目的是制备氢氧化亚铁,先用铁和稀硫酸反应制备硫酸亚铁,此反应在装置2中进行,稀硫酸是溶液,应盛放在分液漏斗中,即应盛放在1处D的分液漏斗中,
故答案为:分液漏斗;
(2)打开B、C,关闭A,利用装置2中产生的氢气,把装置3中的空气排尽,使装置处于还原氛围,然后关闭B,打开A,产生气体压强增大,把产生的FeSO4,压入到装置3中,产生白色沉淀Fe(OH)2,氢氧化亚铁溶液被空气中的氧气所氧化,生成氢氧化铁,对氢氧化亚铁颜色的观察产生干扰,所以要排除装置中的空气,防止生成的氢氧化亚铁被氧化,
故答案为:B;AC;白色;防止生成的氢氧化亚铁被氧化;
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是,将铁粉换成铁块或铁钉,可以防止仪器2中铁粉通过导管进入仪器3中,
故答案为:将铁粉换成铁块或铁钉;
(4)①因为硫酸亚铁铵易溶于水,不溶于乙醇,应该用乙醇洗涤,减少硫酸亚铁铵的溶解,同时利用乙醇和水互溶,从而达到洗涤的要求,故选D,
故答案为:D;
②利用高锰酸钾的强氧化性,Fe2+的强还原性,两者发生氧化还原反应,Fe2+被氧化成Fe3+↑1,Mn由+7价→+2↓5,最小公倍数5,根据原子个数、电荷守恒,即MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,向溶液中滴加中高锰酸钾,高锰酸钾显紫红色,因此滴定到终点:最后一滴滴入,溶液由无色变为浅紫色,且30s不变色,因为第一次与第二次、第三次相差较大,忽略不计,消耗高锰酸钾溶液的体积为 $\frac{25.02+24.98}{2}$ml=25mL,根据离子反应方程式,得出:n[(NH4)2SO4•FeSO4•6H2O]=5n(KMnO4)=25×10-3×c×5mol,则500mL溶液中含有n[(NH4)2SO4•FeSO4•6H2O]=25×10-3×c×5×500/25mol=2.5cmol,
所以质量分数=2.5c×$\frac{392}{a}$×100%=$\frac{980c}{a}$×100%,
A、俯视读数,造成所读的数偏小,故A错误;
B、滴定管尖嘴有气泡,滴定结束无气泡,所消耗的液体体积增加,故B正确;
C、锥形瓶用待测液润洗,待测液的物质的量增加,则消耗高锰酸钾的体积增加,故C正确;
D、三次使用的高锰酸钾都是一样的,消耗的高锰酸钾体积应是相同的,故D错误.
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;最后一滴滴入,溶液由无色变为浅紫色,且30s不变色;$\frac{980c}{a}$×100%;BC.
点评 本题考查了氢氧化亚铁制备的非常规制备方法和实验过程分析判断,滴定实验的注意问题和计算应用,注意掌握物质性质,实验过程的理解应用,掌握基础是解题关键,题目难度中等.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 聚丙烯的结构简式为: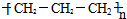 | |
| B. | 已知:正丁烷(C4H10)的二氯代物有六种同分异构体,则它的八氯代物也有六种同分异构体 | |
| C. | 四氯化碳分子的电子式为: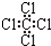 | |
| D. | 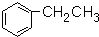 有7种吸收峰 有7种吸收峰 |
| A. | 1:2:3 | B. | 1:3:2 | C. | 2:4:5 | D. | 2:3:1 |
| A. | PCl3 | B. | H2O2 | C. | NO | D. | BF3 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | C | D | F | |||||
| 三 | B | E | G | R | ||||
| 四 | A | H |
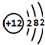 .
.(2)这9种元素中,化学性质最不活泼的是Ar;既具有非金属元素的某些性质,又可能具有金属元素的某些性质的元素是B、Si.(填元素符号)
(3)A、D、E三种元素的最高价氧化物形成的晶体中属于分子晶体的是CO2,A、B两元素的氧化物中熔点较高的是MgO,C、D、F形成的氢化物分子中共价键的极性由强到弱的顺序为H2O>CH4>BH3(或B2H6).(填化学式)
(4)工业上用D的一种单质为原料生产E单质粗品的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si.
(5)G和H的原子序数相差18.(填数字)
(6)写出一个能证明G比H活泼的化学方程式Cl2+2KBr=2KCl+Br2.

(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图1所示:
①反应Ⅰ的离子方程式是SO2+2H2O+I2=SO42-+2I-+4H+,反应Ⅰ得到的产物用I2进行分离,该产物的溶液在过量I2的存在下会分成两层:含低浓度I2的H2SO4层和含高浓度I2的HI层.经离子浓度检测,H2SO4溶液层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因是硫酸层中含少量的HI,且HI电离出氢离子
②反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mo1-1
它由两步反应组成:ⅰ.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ•mo1-1;
ⅱ.SO3(g)分解写出SO3(g)分解的热化学方程式2SO3(g)?2SO2(g)+O2(g)△H=+196kJ•mol-1.
(2)工业上利用吸热反应C(s)+2H2O(g)═CO2(g)+2H2(g),也可制备氢气.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
| C(s) | H2O(g) | H2(g) | |||
| 甲 | 2 | T1 | 2 | 4 | 3.2 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 |
②若乙容器中达到平衡所需时间为3min,则当反应进行到1.5min时,H2O(g)的物质的量的浓度B(填选项字母).
A.=1.4mol/L B.<1.4mol/L C.>1.4mol/L
③某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图2所示.可见在t1、t3、t5、t7时反应都达到了平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,t4时刻改变的条件是降低温度.
(3)如图3是一种电化学制备H2的方法,装置中的MEA为允许质子通过的电解质膜.
①写出阳极电极的反应式:CH3OH+H2O-6e-=CO2↑+6H+.
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为Mg17Al12+17H2=17MgH2+12Al.
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增小 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Na、K、Rb的电子层数依次增多 |
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | ||||||
| 3 | D | E | F | G | H | I | ||
(2)B元素的最高正化合价是+4.
(3)D、E、F三种元素的金属性逐渐减弱(填“减弱”或“增强”).
(4)某元素位于元素周期表中第3周期第VIA族,该元素的原子结构示意图是b(选填编号).
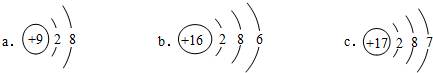
(5)化学键的断裂和形成都伴随着能量变化,那么1mol H2O→2mol H+1 mol O的变化过程要吸收(填“吸收”或“放出”)能量.
 .
.