题目内容
14.化学与生产、生活密切相关.下列叙述正确的是( )| A. | 碳酸氢钠是焙制糕点的发酵粉的一种成分 | |
| B. | CO、NO、NO2都是大气污染物,在空气中都能稳定存在 | |
| C. | 光导纤维和玻璃都是硅酸盐产品 | |
| D. | 明矾能作净水剂,因为它能与水反应生成强氧化性的氢氧化铝胶体 |
分析 A.碳酸氢钠受热会产生二氧化碳;
B.一氧化氮能够与空气中氧气反应生成二氧化氮;
C.光导纤维主要成分是二氧化硅;
D.明矾净水是利用氢氧化铝胶体的吸附性.
解答 解:A.碳酸氢钠不稳定,受热会产生二氧化碳,焙制糕点的发酵粉的一种成分,故A正确;
B.一氧化氮能够与空气中氧气反应生成二氧化氮,所以NO不能在空气中稳定存在,故B错误;
C.光导纤维主要成分是二氧化硅,二氧化硅为氧化物,不是硅酸盐,故C错误;
D.明矾水解生成氢氧化铝胶体,氢氧化铝没有强氧化性,明矾净水是利用氢氧化铝胶体的吸附性,故D错误;
故选:A.
点评 本题考查了元素化合物知识,涉及元素化合物的用途,性质决定用途,明确相关物质的性质即可解答,注意明矾净水原理,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如表所示:
请回答下列问题:
(1)A在元素周期表中的位置是第三周期第ⅡA族;A与E形成的化合物的电子式是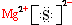 .
.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(4)F的氢氧化物的是两性(填“酸性”“碱性”“两性”)氢氧化物,其电离方程式是Al3++3OH-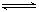 Al(OH)3
Al(OH)3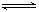 H++AlO2-+H2O;F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
H++AlO2-+H2O;F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
(1)A在元素周期表中的位置是第三周期第ⅡA族;A与E形成的化合物的电子式是
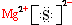 .
.(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+.
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(4)F的氢氧化物的是两性(填“酸性”“碱性”“两性”)氢氧化物,其电离方程式是Al3++3OH-
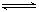 Al(OH)3
Al(OH)3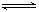 H++AlO2-+H2O;F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
H++AlO2-+H2O;F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
2.等体积、物质的量浓度之比为6:2:3的AClx、BCly、CClz三种盐溶液分别与足量AgNO3溶液反应,生成等量沉淀,则x:y:z为( )
| A. | 1:2:3 | B. | 1:3:2 | C. | 2:4:5 | D. | 2:3:1 |
19.下列分子中每个原子最外层都达到8电子稳定结构的是( )
| A. | PCl3 | B. | H2O2 | C. | NO | D. | BF3 |
6.下表列出了A~R 9种元素在周期表中的位置:
(1)F元素的名称为氧;画出B的原子结构示意图: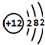 .
.
(2)这9种元素中,化学性质最不活泼的是Ar;既具有非金属元素的某些性质,又可能具有金属元素的某些性质的元素是B、Si.(填元素符号)
(3)A、D、E三种元素的最高价氧化物形成的晶体中属于分子晶体的是CO2,A、B两元素的氧化物中熔点较高的是MgO,C、D、F形成的氢化物分子中共价键的极性由强到弱的顺序为H2O>CH4>BH3(或B2H6).(填化学式)
(4)工业上用D的一种单质为原料生产E单质粗品的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si.
(5)G和H的原子序数相差18.(填数字)
(6)写出一个能证明G比H活泼的化学方程式Cl2+2KBr=2KCl+Br2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | C | D | F | |||||
| 三 | B | E | G | R | ||||
| 四 | A | H |
 .
.(2)这9种元素中,化学性质最不活泼的是Ar;既具有非金属元素的某些性质,又可能具有金属元素的某些性质的元素是B、Si.(填元素符号)
(3)A、D、E三种元素的最高价氧化物形成的晶体中属于分子晶体的是CO2,A、B两元素的氧化物中熔点较高的是MgO,C、D、F形成的氢化物分子中共价键的极性由强到弱的顺序为H2O>CH4>BH3(或B2H6).(填化学式)
(4)工业上用D的一种单质为原料生产E单质粗品的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si.
(5)G和H的原子序数相差18.(填数字)
(6)写出一个能证明G比H活泼的化学方程式Cl2+2KBr=2KCl+Br2.
3.下列各组元素性质活原子结构递变情况错误的是( )
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增小 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Na、K、Rb的电子层数依次增多 |
4.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 11.2 L的戊烷所含的分子数为0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为6NA | |
| C. | 在标准状况,11.2 L三氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、乙炔的混合气体共14 g,其原子数为3NA |
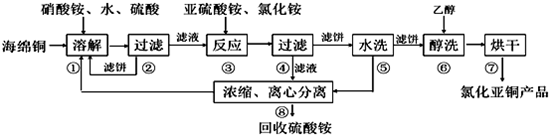
 .其反应类型为消去反应.检验生成的乙烯要将气体先后通入氢氧化钠溶液、酸性高锰酸钾溶液或溴水中.(填试剂名称)
.其反应类型为消去反应.检验生成的乙烯要将气体先后通入氢氧化钠溶液、酸性高锰酸钾溶液或溴水中.(填试剂名称)