题目内容
2.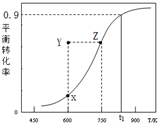 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )| A. | 脱氢反应的△H<0 | B. | 在t1K时,该反应的平衡常数为8.1 | ||
| C. | 600K时,Y点甲醇的υ(正)<υ(逆) | D. | 若增大体系压强,曲线将向上平移 |
分析 A.甲醇脱氢反应为吸热反应还是放热反应由温度对平衡移动的影响确定;
B.由于初始浓度不知,因此对于此反应而言无法求算化学平衡常数;
C.60K时Y点甲醇转化率大于X点甲醇平衡转化率;
D.增大压强,平衡向逆反应方向移动,甲醇转化率减小.
解答 解:A.由图可知,温度越高甲醇平衡转化率越大,说明升高温度化学平衡正向移动,因此甲醇脱氢反应为吸热反应即△H>0,故A错误;
B.由于不知道初始浓度,只有转化率这一条件计算不出平衡浓度,因此无法计算平衡常数,故B错误;
C.600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆),故C正确;
D.若增大压强,平衡向逆反应方向移动,甲醇转化率减小,曲线将向下平移,故D错误;
故选C.
点评 本题考查化学平衡影响因素、化学平衡常数及其计算等知识,题目难度中等,从图中提取有用信息为解答关键,注意熟练掌握影响化学平衡的因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.钾钠合金是原子反应堆的冷却剂.已知:
(1)钾钠合金的硬度比其纯金属小(填“大”或“小”),熔点比其纯金属低(填“高”或“低”).
(2)钾钠合金能作为冷却剂是因为钾钠合金具有良好的导热性(填“导电性”或“导热性”).
(3)制备钾钠合金是在氩气气氛里将这两种固体摇晃,固体逐渐融化,氩气的作用是隔绝空气,防止金属钠和金属钾和空气成分反应.
(4)钾钠合金在反应堆中作冷却剂时,必须密封在真空管里,若遇水则会剧烈反应,合金与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑,2K+2H2O=2KOH+H2↑.
| 钠 | 钾 | 钠钾合金(质量比1:3) | |
| 熔点/℃ | 97.9 | 63.5 | <-10 |
(2)钾钠合金能作为冷却剂是因为钾钠合金具有良好的导热性(填“导电性”或“导热性”).
(3)制备钾钠合金是在氩气气氛里将这两种固体摇晃,固体逐渐融化,氩气的作用是隔绝空气,防止金属钠和金属钾和空气成分反应.
(4)钾钠合金在反应堆中作冷却剂时,必须密封在真空管里,若遇水则会剧烈反应,合金与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑,2K+2H2O=2KOH+H2↑.
7.如表离子在未知溶液中的检验方法正确的是( )
| 选项 | 离子 | 检验方法 |
| A | CO32- | 向样品中加入足量盐酸,将生成的无色无味的气体通入澄清石灰水中,观察溶液是否变浑浊 |
| B | SO42- | 向样品中先加入稀硝酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成 |
| C | Fe2+ | 取少量溶液于试管中,加入酸性高锰酸钾溶液,观察溶液紫色是否褪去 |
| D | I- | 取少量溶液于试管中,加入新制氯水,再加入淀粉溶液,观察溶液是否变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
14.可逆反应FeCl3+3KSCN?Fe(SCN)3+3KCl达到化学平衡后,加人少量的水,平衡的移动情况为( )
| A. | 不移动 | B. | 平衡左移 | C. | 平衡右移 | D. | 无法确定 |
12.下列各反应的产物与反应物用量无关的是( )
| A. | Na2CO3和稀盐酸 | B. | Al2O3和NaOH溶液 | ||
| C. | NH4HCO3和NaOH溶液 | D. | CO2和NaOH溶液 |
 .Y2Z3遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.
.Y2Z3遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.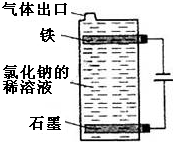 (1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(1)按如图电解氯化钠的稀溶液可制得漂白液,写出该电解池中发生反应的总反应方程式:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;