题目内容
14.一定条件下,在容积为2L的密闭容器里加入一定物质的量的A和B,发生如下反应并建立平衡:A(g)+2B(g)?C(g)+2D(g) 测得平衡时各物质的浓度是:c[A]=0.3mol•L-1,c[B]=0.2mol•L-1,c[C]=0.15mol•L-1.最初向容器里加入A的物质的量是( )| A. | 0.5mol | B. | 0.8mol | C. | 0.9mol | D. | 1.2mol |
分析 依据化学平衡的三段式列式计算,设起始量A的物质的量浓度为x,B的物质的量浓度为y,则得到:
A(g)+2B(g)?C(g)+2D(g)
起始量(mol/L) x y 0 0
变化量(mol/L) 0.15 0.3 0.15 0.3
平衡量(mol/L) 0.3 0.2 0.15 0.3
起始量=消耗量+平衡量,据此计算,注意计算过程中单位的应用;
解答 解:依据化学平衡的三段式列式计算,设起始量A的物质的量浓度为x,B的物质的量浓度为y,则得到:
A(g)+2B(g)?C(g)+2D(g)
起始量(mol/L) x y 0 0
变化量(mol/L) 0.15 0.3 0.15 0.3
平衡量(mol/L) 0.3 0.2 0.15 0.3
最初向容器里加入A的物质的量浓度x=0.3mol/L+0.15mol/L=0.45mol/L;
最初向容器里加入A的物质的量为0.45mol/L×2L=0.9mol;
故选C.
点评 本题考查了化学平衡的三段式计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.如图所示装置是一种可充电电池示意图,装置中的离子交换膜只允许Na+通过.已知充放电的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.下列说法正确的是( )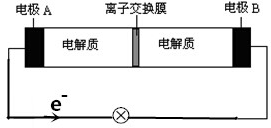

| A. | 放电时,Na+从右到左通过离子交换膜 | |
| B. | 放电时,负极反应式为3NaBr-2e-═NaBr3+2Na+ | |
| C. | 充电时,A极应与直流电源负极相连 | |
| D. | 放电时,当有0.1molNa+通过离子交换膜时,B极上有0.3molNaBr产生 |
9.下列选项中,为完成相应实验,所用仪器、试剂及相关操作合理的是( )
| A. | 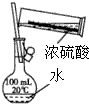 稀释浓硫酸 | |
| B. | 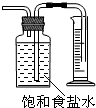 测量Cl2的体积 | |
| C. | 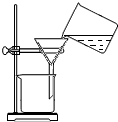 过滤 | |
| D. | 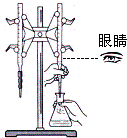 用NaOH标准溶液滴定锥形瓶中的盐酸 |
3.下列说法正确的是( )
| A. | Na2O2中含有共价键,故是共价化合物 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,但化学性质几乎相同 | |
| D. | Fe(OH)3胶体是纯净物 |