题目内容
6.一定物质的量浓度硫酸铜溶液的配制.①已知室温下饱和硫酸铜溶液的质量百分数为20%,密度为1.2g•cm-3,现要用这种饱和硫酸铜溶液来配制240mL 0.05mol•L-1硫酸铜溶液,实验中需要用置筒量取饱和硫酸铜溶液8.3mL.
②从下列选项中选出实验中不需要用到的仪器或用品ADE(填序号).
A、天平 B、100mL烧杯 C、10mL量筒 D、50mL量筒
E、100mL容量瓶 F、250mL容量瓶 G、玻璃棒
实验中还缺少的重要仪器是胶头滴管.
③下列操作将使所配溶液物质的量浓度偏高的是AD.
A.在量取饱和硫酸铜溶液时仰视读数
B.移液时不小心溅出少许溶液
C.容量瓶查漏后未经干燥就直接使用
D.定容时俯视容量瓶刻度线
E.未洗涤烧杯和玻璃棒.
分析 ①先根据c=$\frac{1000ω}{M}$计算出浓溶液的物质的量浓度为,然后根据溶液稀释定律c浓V浓=c稀V稀来计算;
②根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析缺少的仪器和不需要的仪器;
③根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:①由于实验室无240mL容量瓶,故应选择250mL的容量瓶,故配制出250mL溶液.浓硫酸铜的物质的量浓度为c=$\frac{1000ω}{M}$=$\frac{1000×1.2×20%}{160}$mol/L=1.5mol/L,
设所需的浓硫酸铜溶液的体积为VmL,根据溶液稀释定律c浓V浓=c稀V稀可知:1.5mol/L×VmL=0.05mol/L×250mL,解得:V=8.3mL,
故答案为:8.3;
②根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有10mL量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故不需要的是ADE,还缺少的仪器是胶头滴管,
故答案为:ADE;胶头滴管;
③A.在量取饱和硫酸铜溶液时仰视读,则所量取的硫酸铜溶液的体积偏大,配制出的溶液的浓度偏高,故A正确;
B.移液时不小心溅出少许溶液,会导致溶质的损失,则溶液浓度偏低,故B错误;
C.容量瓶查漏后未经干燥就直接使用,对溶液的浓度无影响,故C错误;
D.定容时俯视容量瓶刻度线,则溶液体积偏小,浓度偏高,故D正确;
E.未洗涤烧杯和玻璃棒,会导致溶质的损失,则浓度偏低,故E错误;
故答案为:AD.
点评 本题考查了配制一定物质的量浓度的溶液,题目难度中等,明确配制一定物质的量浓度的溶液步骤为解答关键,注意掌握误差分析的方法与技巧,试题培养了学生的化学实验能力.

| A. | 硫酸氢钠 | B. | 明矾 | C. | 碳酸氢钠 | D. | 醋酸钠 |
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| A. | 0.5mol | B. | 0.8mol | C. | 0.9mol | D. | 1.2mol |
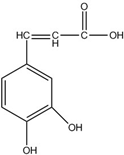
| A. | 分子式为C9H5O4 | |
| B. | 1mol该有机物最多可与3mol氢气发生加成反应 | |
| C. | 与溴水既能发生取代反应,又能发生加成反应 | |
| D. | 能与Na2CO3溶液反应,也能与NaHCO3溶液反应 |
| A. | NH4+ Ba2+ Cl- CO32- | B. | ClO- SO42- Fe2+ H+ | ||
| C. | K+ Na+ SO42- MnO4- | D. | Na+ H+ NO3-HCO3- |
| A. | 加热 | B. | 不用铁片,改用铁粉 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用稀硫酸,改用浓硝酸 |
| 实验设计 | 预期目的 | |
| A | 在相同温度下,分别取等质量的大理石块、大理石粉末分别与等体积等浓度的稀硫酸反应 | 探究反应物接触面积对化学反应速率的影响 |
| B | 把盛有颜色相同的NO2和N2O4的混合气体的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 反应Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,向甲试管中滴加5ml 0.05mol/L的Na2S2O3和5ml 0.02mol/LH2SO4,乙试管中滴加10ml 0.05mol/L的Na2S2O3和10ml 0.02mol/LH2SO4 | 探究浓度对化学平衡的影响 |
| D | 相同温度下,向两支盛有等体积等浓度H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液 | 探究不同催化剂对同一反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
 实验室需要配制0.50mol/L NaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整.