题目内容
19.资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.Ⅰ、有科学家提出可利用FeO吸收和利用CO2,相关化学方程式如下:6FeO+CO2═2Fe3O4+C;若用足量氢碘酸溶解Fe3O4溶解后的溶液中加入KSCN后溶液不变红(已知氢碘酸的酸性比盐酸强).
(1)上述反应中每生成1mol Fe3O4,转移电子的物质的量为2mol.
(2)写出氢碘酸溶解Fe3O4的离子方程式Fe3O4+2I-+8H+═3Fe2++I2+4H2O.
Ⅱ、在一定条件下,可发生如下反应:CO2(g)+4H2 (g)?CH4 (g)+2H2O(g),向一容积为 2L的恒容密闭容器中充人一定量的CO2和H2,在 300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol•L一1,H2:0.8mol•L一1,CH4:0.8mol•L一1,H2O:1.6mol•L一1.则300℃时上述反应的平衡常数K=25. 200℃时该反应的平衡常数K=64.8,则该反应的△H< (填“>”或“<”)0.
Ⅲ、已知C(石墨)、H2(g)燃烧的热化学方程式分别为:
①C(石墨)+$\frac{1}{2}$O2(g)═CO(g)△H=-111.0KJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H20(g)△H=-242.0kJ•mol-1
③C(石墨)+O2(g)═CO2(g)△H=-394.0kJ•mol-1
请解答下列问题:
(1)工业制氢气的一个重要途径是用CO(g)与H2O(g)反应生成CO2(g)和H2(g),则该反应的热化学方程式是CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ•mol-1.
(2)若C(金刚石)+O2(g)═CO2(g)的△H=-395.0kJ•mol-1,则稳定性:金刚石<(填“>”、“<”或“=”)石墨.
(3)已知形成H20(g)中的2mol H-O键能放出926.0kJ的能量,形成1mol 02(g)中的共价键能放出498.0kJ的能量,则断裂1mol H2(g)中的H-H键需要的能量435KJ.
分析 I.(1)根据方程式计算生成C的物质的量,结合碳元素化合价变化计算转移电子;
(2)用足量氢碘酸溶解Fe3O4溶解后的溶液中加入KSCN后溶液不变红,反应生成碘化亚铁、碘单质与水;
Ⅱ.根据K=$\frac{c(C{O}_{2})×{c}^{2}({H}_{2}O)}{c(C{O}_{2})×{c}^{4}({H}_{2})}$计算平衡常数,根据温度对平衡常数的影响判断正反应反应是吸热还是放热;
Ⅲ.(1)已知:①C(石墨)+$\frac{1}{2}$O2(g)═CO(g)△H=-111.0KJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H20(g)△H=-242.0kJ•mol-1
③C(石墨)+O2(g)═CO2(g)△H=-394.0kJ•mol-1
根据盖斯定律,③-①-②可得:CO(g)+H2O(g)=CO2(g)+H2(g);
(2)由热化学方程式可知,金刚石的能量比石墨的高,能量越低越稳定;
(3)反应热=反应物总键能-生成物总键能.
解答 解:I.(1)由方程式可知,生成C的物质的量为1mol×$\frac{1}{2}$=0.5mol,则转移电子为0.5mol×4=2mol,
故答案为:2;
(2)用足量氢碘酸溶解Fe3O4溶解后的溶液中加入KSCN后溶液不变红,反应生成碘化亚铁、碘单质与水,反应离子方程式为:Fe3O4+2I-+8H+═3Fe2++I2+4H2O,
故答案为:Fe3O4+2I-+8H+═3Fe2++I2+4H2O;
Ⅱ.300℃时平衡常数K=$\frac{c(C{O}_{2})×{c}^{2}({H}_{2}O)}{c(C{O}_{2})×{c}^{4}({H}_{2})}$=$\frac{0.8×1.{6}^{2}}{0.2×0.{8}^{4}}$=25,200℃时该反应的平衡常数K=64.8,降低温度平衡常数增大,平衡正向移动,则正反应为放热反应,则该反应的△H<0,
故答案为:25;<;
Ⅲ.(1)已知:①C(石墨)+$\frac{1}{2}$O2(g)═CO(g)△H=-111.0KJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H20(g)△H=-242.0kJ•mol-1
③C(石墨)+O2(g)═CO2(g)△H=-394.0kJ•mol-1
根据盖斯定律,③-①-②可得:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ•mol-1,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ•mol-1;
(2)由:C(石墨)+O2(g)═CO2(g)△H=-394.0kJ•mol-1,
C(金刚石)+O2(g)═CO2(g)的△H=-395.0kJ•mol-1,
可知金刚石的能量比石墨的高,能量越低越稳定,故稳定性:金刚石<石墨,
故答案为:<;
(3)设断裂1mol H2(g)中的H-H键需要的能量为x KJ,由H2(g)+$\frac{1}{2}$O2(g)═H20(g)△H=-242.0kJ•mol-1,则:x kJ/mol+$\frac{1}{2}$×498kJ/mol-926.0kJ/mol=-242.0kJ/mol,解得x=435,
故答案为:435.
点评 本题考查化学平衡常数及影响因素、氧化还原反应、反应热有关计算等,属于拼合型题目,注意理解掌握键能与反应热关系,难度中等.

 阅读快车系列答案
阅读快车系列答案
| A. | W可能是非金属元素 | |
| B. | X可能是氧化物 | |
| C. | Y、Z之间的转化可能是氧化还原反应 | |
| D. | Y和Z在溶液中反应可能生成X |
| A. | 51% | B. | 56% | C. | 57% | D. | 10% |
| A. | CaCO3 | B. | C | C. | NaOH溶液 | D. | 浓硫酸 |
| A. | 0.5mol | B. | 0.8mol | C. | 0.9mol | D. | 1.2mol |
| A. | NH4+ Ba2+ Cl- CO32- | B. | ClO- SO42- Fe2+ H+ | ||
| C. | K+ Na+ SO42- MnO4- | D. | Na+ H+ NO3-HCO3- |
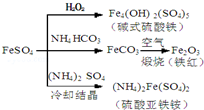
| A. | 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 | |
| B. | 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 | |
| C. | 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 | |
| D. | 常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水 |
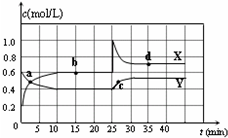 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )| A. | 图中Y曲线是表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内v(N2O4)为0.1 mol/( L•min) | |
| C. | 25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L | |
| D. | 25 min时,导致平衡移动的原因是向容器通入适量NO2 |
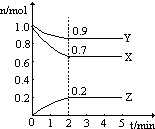 某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,
某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,