题目内容
9.下列选项中,为完成相应实验,所用仪器、试剂及相关操作合理的是( )| A. |  稀释浓硫酸 | |
| B. |  测量Cl2的体积 | |
| C. |  过滤 | |
| D. |  用NaOH标准溶液滴定锥形瓶中的盐酸 |
分析 A.容量瓶不能稀释后溶解药品;
B.饱和氯化钠溶液抑制氯气溶解,所以可以采用排饱和食盐水的方法收集氯气;
C.过滤时要用玻璃棒引流,且漏斗尖嘴应该紧靠烧杯内壁;
D.中和滴定时眼睛观察锥形瓶内溶液颜色变化.
解答 解:A.容量瓶不能稀释后溶解药品,容量瓶只能配制一定物质的量浓度溶液,故A错误;
B.饱和氯化钠溶液抑制氯气溶解,所以可以采用排饱和食盐水的方法收集氯气,且集气瓶中导气管采用“短进长出”原则,故B正确;
C.过滤时要用玻璃棒引流,且漏斗尖嘴应该紧靠烧杯内壁,所以该操作错误,故C错误;
D.中和滴定时眼睛观察锥形瓶内溶液颜色变化,否则会导致测量不准确,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器的使用、气体收集、基本操作等知识点,明确实验原理、基本操作方法等是解本题关键,注意评价性分析,题目难度不大.

练习册系列答案
相关题目
3.分子式为C7H8O2并能与金属钠反应的芳香化合物有( )
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
20.体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2?2SO3,并达到平衡.在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
17.将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合后,溶液中下列微粒的物质的量浓度的关系正确的是( )
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
4.下列各浓度关系正确的是( )
| A. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| B. | 常温下,NH4Cl和NH3•H2O混合溶液的PH=7:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸溶液中加入适量醋酸钠,得到的碱性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 常温下,向硝酸钾溶液中滴加稀盐酸得到的pH=5的混合溶液:c(K+)>c(NO3-) |
14.一定条件下,在容积为2L的密闭容器里加入一定物质的量的A和B,发生如下反应并建立平衡:A(g)+2B(g)?C(g)+2D(g) 测得平衡时各物质的浓度是:c[A]=0.3mol•L-1,c[B]=0.2mol•L-1,c[C]=0.15mol•L-1.最初向容器里加入A的物质的量是( )
| A. | 0.5mol | B. | 0.8mol | C. | 0.9mol | D. | 1.2mol |
1.已知某有机物的结构如图所示.关于该有机物的描述正确的是 ( )
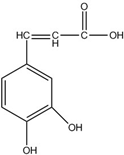

| A. | 分子式为C9H5O4 | |
| B. | 1mol该有机物最多可与3mol氢气发生加成反应 | |
| C. | 与溴水既能发生取代反应,又能发生加成反应 | |
| D. | 能与Na2CO3溶液反应,也能与NaHCO3溶液反应 |
18.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
| A. | 加热 | B. | 不用铁片,改用铁粉 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用稀硫酸,改用浓硝酸 |
19.下列说法正确的是( )
| A. | 相同体积和相同物质的量浓度的不同溶液里所含溶质的物质的量相同 | |
| B. | 10 mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5 mol/L | |
| C. | 溶液中溶质质量分数为w,密度为ρ g•cm-3,溶质摩尔质量为M g•mol-1的溶液的物质的量浓度为$\frac{ρw}{M}$ mol/L | |
| D. | 一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 |