题目内容
7.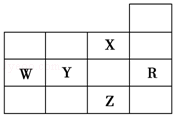 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | W元素的电负性大于Y元素的电负性 | |
| B. | X元素是电负性最大的元素 | |
| C. | p能级未成对电子最多的是Z元素 | |
| D. | Y、Z的阴离子电子层结构都与R原子的相同 |
分析 由元素在周期表的位置可知,X为F,W为P,Y为S,R为Ar,Z为Br,
A.非金属性越强,电负性越大;
B.F的非金属性最强;
C.p能级未成对电子最多为3个;
D.Z的阴离子电子层结构比R原子的多1个电子层.
解答 解:由元素在周期表的位置可知,X为F,W为P,Y为S,R为Ar,Z为Br,
A.非金属性S>P,W元素的电负性小于Y元素的电负性,故A错误;
B.F的非金属性最强,则X元素是电负性最大的元素,故B正确;
C.p能级未成对电子最多为3个,则p能级未成对电子最多的是W元素,故C错误;
D.Z的阴离子电子层结构比R原子的多1个电子层,而Y的阴离子电子层结构都与R原子的相同,故D错误;
故选B.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,C为解答的难点,题目难度不大.

练习册系列答案
相关题目
17.下列离子方程式正确的是( )
| A. | 用Na2O2和H2O 反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 用氢氧化钠溶液除去金属铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 用食醋除去水瓶中的水垢:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O | |
| D. | 等体积、等浓度的Ba(OH)2浓溶液和NH4HCO3 浓溶液混合后并加热Ba2++OH-+HCO3-═BaCO3↓+2H2O |
15.某食品干燥剂的主要成分是氧化钙.氧化钙(CaO)应属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
2.下列变化中,属于还原反应的是( )
| A. | KMnO4→MnO2 | B. | FeCl2→FeCl3 | C. | C→CO2 | D. | Cl-→Cl2 |
12.某溶液含有①NO3-②HCO3-③SO32-④CO32-⑤SO42-等五种阴离子.向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积的变化)( )
| A. | ① | B. | ①②④ | C. | ①③⑤ | D. | ①③④⑤ |
19.下列说法与判断正确的是( )
| A. | 存在系统命名为1-甲基-2-乙基辛烷的烷烃,其分子式为C11H24 | |
| B. | 乙醛和丙烯醛(CH2=CHCHO)不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| C. | 通过测定反应前后溶液导电性的变化可判断在稀苯酚溶液中加入少量浓溴水时发生的是取代反应而不是加成反应 | |
| D. | 煤经加工所得的产物中存在大量的多环芳烃和稠环芳烃,如二甲联苯( )、萘( )、萘( )、蒽( )、蒽( )等,这些芳烃均属于苯的同系物 )等,这些芳烃均属于苯的同系物 |
2.乙醇是一种优质的液体燃料,二甲醚与合成气制乙醇是目前合成乙醇的一种新途径,总反应为:CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g).向反应系统中同时通入二甲醚、一氧化碳和氢气,先生成中间产物乙酸甲酯后,继而生成乙醇.发生的主要化学反应有:
回答下列问题:
(1)二甲醚碳基化反应的△H<0 (填“>”“<”“=”).
(2)若反应在恒温恒容下进行,下列可说明反应已经达到平衡状态的是BD.
A.2v(CH3COOCH3)=v(H2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度保持不变
D.密闭容器中C2H5OH的体积分数保持不变
(3)总反应CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g)的平衡常数表达式K=$\frac{c({C}_{2}{H}_{5}OH)c(C{H}_{3}OH)}{c(C{H}_{3}OC{H}_{3})c(CO){c}^{2}({H}_{2})}$,随温度的升高,总反应的K将减小 (填“增大”、“不变”或“减小”).
(4)在压强为1Mpa条件下,温度对二甲醚和乙酸甲酯平衡转化率影响如图1所示,温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示.观察图2可知乙酸甲酯含量在 300K~600K范围内发生变化是随温度升高而增大,简要解释产生这种变化的原因该温度范围,反应Ⅰ转化率都很大,反应Ⅱ的转化率随温度升高而减小,所以乙酸甲酯的含量升高.
(5)将CH3OCH3(g)和CO(g)按物质的量之比1:1充入密闭容器中发生碳基化反应,在T K时,反应进行到不同时间测得各物质的浓度如下:
①20min时,只改变了某一条件,根据上表中的数据判断改变的条件可能是C(填字母).
A.通入一定量的CO B.移出一定量的CH3OCH3C.加入合适的催化剂
②在图3中画出TK,CH3COOCH3(g)的体积分数随反应时间的变化曲线.

| 反应过程 | 化学方程式 | 不同温度下的K | ||
| 273.15K | 1000K | |||
| Ⅰ | 二甲醚羰基化反应 | CH3OCH3(g)+CO(g)?CH3COOCH3(g) | 1016.25 | 101.58 |
| Ⅱ | 乙酸甲酯加氢反应 | CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g) | 103.97 | 10-0.35 |
(1)二甲醚碳基化反应的△H<0 (填“>”“<”“=”).
(2)若反应在恒温恒容下进行,下列可说明反应已经达到平衡状态的是BD.
A.2v(CH3COOCH3)=v(H2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度保持不变
D.密闭容器中C2H5OH的体积分数保持不变
(3)总反应CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g)的平衡常数表达式K=$\frac{c({C}_{2}{H}_{5}OH)c(C{H}_{3}OH)}{c(C{H}_{3}OC{H}_{3})c(CO){c}^{2}({H}_{2})}$,随温度的升高,总反应的K将减小 (填“增大”、“不变”或“减小”).
(4)在压强为1Mpa条件下,温度对二甲醚和乙酸甲酯平衡转化率影响如图1所示,温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示.观察图2可知乙酸甲酯含量在 300K~600K范围内发生变化是随温度升高而增大,简要解释产生这种变化的原因该温度范围,反应Ⅰ转化率都很大,反应Ⅱ的转化率随温度升高而减小,所以乙酸甲酯的含量升高.
(5)将CH3OCH3(g)和CO(g)按物质的量之比1:1充入密闭容器中发生碳基化反应,在T K时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| CH3OCH3(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CO(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CH3COOCH3(g) | 0 | 0.20 | 0.30 | 1.00 | 1.50 | 1.50 |
A.通入一定量的CO B.移出一定量的CH3OCH3C.加入合适的催化剂
②在图3中画出TK,CH3COOCH3(g)的体积分数随反应时间的变化曲线.

3.对于溶液中的反应:2KMnO4+10FeSO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O,下列措施能使化学反应速率提高的是( )
| A. | 加水 | B. | 增加同浓度FeSO4的用量 | ||
| C. | 加压 | D. | 加入少量KMnO4晶体 |