题目内容
18.欲用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL.(1)选用的主要仪器有:①量筒,②烧杯,③玻璃棒,④500mL容量瓶,⑤胶头滴管.
(2)现有下列配制操作:
A.用量筒量取浓H2SO4B.反复颠倒摇匀
C.用胶头滴管加水至刻度线 D.洗涤烧杯和玻璃棒2-3次,并洗涤液也转移到容量瓶中,振荡摇匀 E.稀释浓H2SO4 F.将溶液转入容量瓶
正确的操作顺序为:AEFDCB.
(3)简要回答下列问题:
①所需浓硫酸的体积为13.6mL.
②如果实验室有15mL、20mL、50mL的量筒,应选用15mL的量筒最好,量取时发现量筒不干净,用水洗净后直接量取,将使配制的浓度偏低(偏高、偏低、无影响).
③取配制好溶液100ml,加水稀释到500ml,此时溶液中H+ 的物质的量浓度是0.2mol/L.
分析 (1)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀,据此选择需要仪器;
(2)依据配制溶液一般步骤排序;
(3)①依据溶液稀释过程中溶质的物质的量不变计算;
②依据浓硫酸体积选择量筒规格;量取时发现量筒不干净,用水洗净后直接量取,导致量取的浓硫酸含有硫酸的物质的量偏小,依据C=$\frac{n}{V}$进行误差分析;
③依据溶液稀释规律:稀释过程中溶质的物质的量不变计算稀释后硫酸的物质的量浓度,结合硫酸为强电解质,1mol硫酸电离产生2mol氢离子计算氢离子物质的量浓度.
解答 解:(1)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀,用到的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管;
故答案为:①量筒,②烧杯,③玻璃棒,④容量瓶,⑤胶头滴管;
(2)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为:AEFDCB;
故答案为:AEFDCB;
(3)①设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=500mL×0.5mol/L,解得V=13.6mL;
故答案为:13.6mL;
②量取13.6mL浓硫酸应选择15mL量筒;量取时发现量筒不干净,用水洗净后直接量取,导致量取的浓硫酸含有硫酸的物质的量偏小,依据C=$\frac{n}{V}$可知,溶液浓度偏低;
故答案为:15,偏低;
③设稀释后硫酸物质的量浓度为C,则依据稀释规律得:C×500mL=0.5mol/L×100mL,解得C=0.1mol/L,则氢离子物质的量浓度为:0.1mol/L×2=0.2mol/L;
故答案为:0.2mol/L.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧,题目难度不大.

| A. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| B. | 含金属元素的离子一定是阳离子 | |
| C. | 金属单质只有还原性,金属阳离子不一定只有氧化性 | |
| D. | 不同的气体,若体积不同,则它们所含的分子数一定不同 |
| A. | NaCl | B. | Na2S | C. | Na2SO4 | D. | KNO3 |
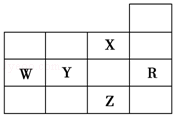 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | W元素的电负性大于Y元素的电负性 | |
| B. | X元素是电负性最大的元素 | |
| C. | p能级未成对电子最多的是Z元素 | |
| D. | Y、Z的阴离子电子层结构都与R原子的相同 |

