题目内容
18.下列实验中,所采取的分离方法不正确的是( )| 选项 | 目的 | 分离方法 |
| A | 除去铜器表面的铜绿[Cu2(OH)2CO3] | 用盐酸浸泡,再用清水冲洗 |
| B | 除去乙醇中的少量水 | 加生石灰,再蒸馏 |
| C | 除去苯中含有苯酚杂质 | 加入溴水,过滤 |
| D | 除去NaCl固体中的NH4Cl | 加热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铜绿与盐酸反应,而铜不反应;
B.水与氧化钙反应,可增大混合物的沸点差;
C.三溴苯酚溶于苯;
D.氯化铵不稳定,加热易分解.
解答 解:A.铜与盐酸不反应,而Cu2(OH)2CO3可溶于盐酸,可用盐酸除杂,故A正确;
B.生石灰与水反应,可增大混合物沸点差,可用蒸馏的方法分离,故B正确;
C.三溴苯酚溶于苯,应加入氢氧化钠溶液除杂,故C错误;
D.氯化铵不稳定,加热易分解,可除杂,故D正确.
故选C.
点评 本题考查物质的分离、提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.向 50mL 18mol/L 的浓硫酸中加入足量的铜片并加热,充分反应后,待溶液冷却后加入足量BaCl2 溶液,生成沉淀的物质的量是( )
| A. | 等于0.9mol | B. | 等于0.45mol | C. | 小于0.45 mol | D. | 大于0.45 mol |
9.下列有关物质的性质和该性质的应用均正确的是( )
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | 碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 | |
| C. | 氢氟酸具有强酸性,可用于雕刻玻璃 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
6.下列反应中,既能表现出硝酸的酸性,又能表现出其氧化性的是( )
| A. | 久置的浓硝酸显黄色 | |
| B. | 铜片放入硝酸中,溶液变蓝 | |
| C. | 碳单质放入浓硝酸中产生大量红棕色的气体 | |
| D. | 浓硝酸敞口放置在空气中,质量会减少 |
3.等质量的下列物质中,所含分子数最多的是( )
| A. | Cl2 | B. | HCl | C. | CO2 | D. | H2 |
10.已知酸性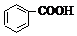 >H2CO3>
>H2CO3> >HCO3-,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3-,向Na2CO3溶液中逐滴加入水杨酸( )溶液,可能发生的反应的离子方程式书写正确的是( )
)溶液,可能发生的反应的离子方程式书写正确的是( )
 >H2CO3>
>H2CO3> >HCO3-,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3-,向Na2CO3溶液中逐滴加入水杨酸( )溶液,可能发生的反应的离子方程式书写正确的是( )
)溶液,可能发生的反应的离子方程式书写正确的是( )| A. | 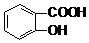 +CO32-→ +CO32-→ +HCO3- +HCO3- | B. |  +CO32-→ +CO32-→ +H2O+CO2↑ +H2O+CO2↑ | ||
| C. | 2 +CO32-→2 +CO32-→2 +CO2↑ +CO2↑ | D. | 3 +2CO32-→3 +2CO32-→3 +HCO3-+H2O+CO2↑ +HCO3-+H2O+CO2↑ |
7. 在两支小试管中分别加入5mL 盐酸和5mL硫酸,再分别放入一段大小相同且纯度>99.5%铝片,实验现象如表所示.
在两支小试管中分别加入5mL 盐酸和5mL硫酸,再分别放入一段大小相同且纯度>99.5%铝片,实验现象如表所示.
(1)根据铝与盐酸反应的实验回答下列问题:(每空2分)
①开始时无明显现象的原因是铝片表面存在致密的氧化膜.
②6min至8min反应越来越快原因是(氧化膜除去后)反应放出大量热使溶液温度升高,反应速率增大.
③实验中出现了大量灰色物质主要是铝,证实你的判断的实验依据是反应结束后溶液澄清透明(或铝片纯度>99.5%).
(2)为了探究铝与稀盐酸、稀硫酸反应明显不同,某学习小组进行如下探究:
【查阅资料】
铝是活泼金属,能迅速与空气或水中氧气形成致密氧化物薄膜,保护铝不被氧化.
氢离子能与氧化膜中的氧离子结合成水,但薄膜中铝离子阻碍氢离子与氧离子的反应.
氯离子能穿透氧化膜,代替氧离子而破坏氧化膜,同时阻碍氧化膜的形成.
铝能与汞形成铝汞齐(合金),铝就不能形成氧化膜.
【提出假设】:
假设一:SO42-能阻碍金属铝与H+反应
假设二:钝化膜能阻碍金属铝与H+反应
为了验证上述假设,某学习小组经过讨论进行如下实验设计:
【实验探究】(以下实验均在室温下进行,溶液体积均为5mL,所用晶体物质的量均相等,所有铝片大致相同)
回答下列问题
①请完成上表中的实验结论.
②设计实验D的目的是:排除Na+对反应速率的影响(或反应速率与Na+的增加和减少无关)
③除去氧化膜的铝片在F、G实验中出现少量气泡后反应停止的原因是:重新生成致密氧化膜.
 在两支小试管中分别加入5mL 盐酸和5mL硫酸,再分别放入一段大小相同且纯度>99.5%铝片,实验现象如表所示.
在两支小试管中分别加入5mL 盐酸和5mL硫酸,再分别放入一段大小相同且纯度>99.5%铝片,实验现象如表所示. | 1min | 6min | 8min | 20min | |
| 3mol?L-1盐酸 | 少量 气泡 | 较多 气泡 | 大量气泡,出现灰色物质 | 气泡消失,溶液澄清透明 |
| 1.5mol?L-1 硫酸 | 无明显现象(无气泡) | |||
①开始时无明显现象的原因是铝片表面存在致密的氧化膜.
②6min至8min反应越来越快原因是(氧化膜除去后)反应放出大量热使溶液温度升高,反应速率增大.
③实验中出现了大量灰色物质主要是铝,证实你的判断的实验依据是反应结束后溶液澄清透明(或铝片纯度>99.5%).
(2)为了探究铝与稀盐酸、稀硫酸反应明显不同,某学习小组进行如下探究:
【查阅资料】
铝是活泼金属,能迅速与空气或水中氧气形成致密氧化物薄膜,保护铝不被氧化.
氢离子能与氧化膜中的氧离子结合成水,但薄膜中铝离子阻碍氢离子与氧离子的反应.
氯离子能穿透氧化膜,代替氧离子而破坏氧化膜,同时阻碍氧化膜的形成.
铝能与汞形成铝汞齐(合金),铝就不能形成氧化膜.
【提出假设】:
假设一:SO42-能阻碍金属铝与H+反应
| 实验方案 | 现象 | 实验结论 | ||
| A | 3mol•L-1盐酸 | / | 产生较多气泡 | / |
| B | 3mol•L-1盐酸 | Na2SO4晶体少量 | 与A无明显差异 | 假设一:不成立. (填“成立”、“不成立”) |
| C | 1.5mol•L-1硫酸 | NaCl晶体少量 | 与A无明显差异 | |
| D | 3mol•L-1盐酸 | NaCl晶体少量 | 与A无明显差异 |
| E | 1.5mol•L-1硫酸 | 无现象 | ||
| F | 1.5mol•L-1硫酸 | 铝片用砂纸打磨 | 少量气泡后停止 | 假设二:成立. (填“成立”、“不成立”) |
| G | 1.5mol•L-1硫酸 | 铝片用食盐水泡1天再取出清洗 | 少量气泡后停止 | |
| H | 1.5mol•L-1硫酸 | 铝片插入Hg(NO3)2溶液再取出清洗 | 表面有较多气泡 | |
| I | 1.5mol•L-1硫酸 | 铝片插入Cu(NO3)2溶液再取出清洗 | 无气泡 |
【实验探究】(以下实验均在室温下进行,溶液体积均为5mL,所用晶体物质的量均相等,所有铝片大致相同)
回答下列问题
①请完成上表中的实验结论.
②设计实验D的目的是:排除Na+对反应速率的影响(或反应速率与Na+的增加和减少无关)
③除去氧化膜的铝片在F、G实验中出现少量气泡后反应停止的原因是:重新生成致密氧化膜.
8.某烷烃的结构为: ,下列命名正确的是( )
,下列命名正确的是( )
 ,下列命名正确的是( )
,下列命名正确的是( )| A. | 2,4-二甲基-3-乙基己烷 | B. | 3-异丙基-4-甲基已烷 | ||
| C. | 2-甲基-3,4-二乙基戊烷 | D. | 3-甲基-4-异丙基已烷 |



