题目内容
10.已知酸性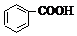 >H2CO3>
>H2CO3> >HCO3-,向Na2CO3溶液中逐滴加入水杨酸(
>HCO3-,向Na2CO3溶液中逐滴加入水杨酸( )溶液,可能发生的反应的离子方程式书写正确的是( )
)溶液,可能发生的反应的离子方程式书写正确的是( )| A. | 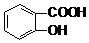 +CO32-→ +CO32-→ +HCO3- +HCO3- | B. |  +CO32-→ +CO32-→ +H2O+CO2↑ +H2O+CO2↑ | ||
| C. | 2 +CO32-→2 +CO32-→2 +CO2↑ +CO2↑ | D. | 3 +2CO32-→3 +2CO32-→3 +HCO3-+H2O+CO2↑ +HCO3-+H2O+CO2↑ |
分析 酸性强弱顺序是羧基>碳酸>酚羟基>HCO3-,所以水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,最后在和酚羟基反应.如果水杨酸过量,还会生成CO2气体.
解答 解:A.酸性: >H2CO3,羧基酸性大于酚羟基,先发生羧基与碳酸钠的反应,
>H2CO3,羧基酸性大于酚羟基,先发生羧基与碳酸钠的反应, +CO32-→
+CO32-→ +HCO3-,故A错误;
+HCO3-,故A错误;
B.酸性: >
> >HCO3-,羧基酸性大于酚羟基,酚羟基酸性强于碳酸氢钠,水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,故B错误;
>HCO3-,羧基酸性大于酚羟基,酚羟基酸性强于碳酸氢钠,水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,故B错误;
C.滴入过程中,水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,再和酚羟基反应,后继续加入会反应生成二氧化碳和水,选项中少水,正确的方程式为:2 +CO32-→2
+CO32-→2 +CO2↑+H2O,故C错误;
+CO2↑+H2O,故C错误;
D.滴入过程中,水杨酸和碳酸钠反应时首先应该是和羧基反应,生成碳酸氢钠,再和酚羟基反应,后继续加入会反应生成二氧化碳,故D正确;
故选D.
点评 本题考查水杨酸和碳酸钠反应的有关判断,该题的关键是明确酸性的强弱顺序,如何灵活运用即可.有利于培养学生严谨的逻辑推理能力和抽象思维能力,提高学生的答题效率,题目难度中等,属于易错题.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
9.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中只以化合态的形式存在,形成的单质是良好的半导体材料 | |
| B. | 单质常用作半导体材料和光导纤维 | |
| C. | 最高价氧化物是酸性氧化物,不能与酸反应 | |
| D. | 最高价氧化物对应的水化物的酸性比磷酸强 |
1.将溶质的质量分数为a%的NaOH溶液蒸发掉m g水后,变成溶质的质量分数为2a%的NaOH不饱和溶液Vml,所得溶液的物质的量浓度为( )
| A. | $\frac{ma}{V}$ mol/L | B. | $\frac{ma}{200V}$ mol/L | C. | $\frac{m}{2aV}$mol/L | D. | $\frac{ma}{2V}$ mol/L |
18.下列实验中,所采取的分离方法不正确的是( )
| 选项 | 目的 | 分离方法 |
| A | 除去铜器表面的铜绿[Cu2(OH)2CO3] | 用盐酸浸泡,再用清水冲洗 |
| B | 除去乙醇中的少量水 | 加生石灰,再蒸馏 |
| C | 除去苯中含有苯酚杂质 | 加入溴水,过滤 |
| D | 除去NaCl固体中的NH4Cl | 加热 |
| A. | A | B. | B | C. | C | D. | D |
5.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3nm)恢复了磁性.“钴酞菁”分子的结构和性质与人体内的血红素及植物体内的叶绿素非常相似.下列说法中不正确的是( )
| A. | “钴酞菁”分子分散在水中所形成的分散系具有丁达尔效应 | |
| B. | “钴酞菁”分子能透过半透膜 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | “钴酞菁”分子分散在水中所形成的分散系显电中性 |
15.下列离子反应方程式正确的是( )
| A. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O=4NH4++AlO2-+2H2O | |
| B. | 向NaHCO3溶液中加入少量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | NO2与水的反应:3NO2+H2O=2HNO3+NO | |
| D. | 工业冶炼金属钠:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2 |
2.下列各组热化学方程式中,化学反应的△H前者与后者几乎相等的是( )
| A. | C(s)+O2(g)═CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2 | |
| B. | C2H4(g)+H2(g)═C2H6(g)△H3 C3H6(g)+H2(g)═C3H8(g)△H4 | |
| C. | S(s)+O2(g)═SO2(g)△H5 S(g)+O2(g)═SO2(g)△H6 | |
| D. | 2H2O(l)═2H2(g)+O2(g)△H7 2H2(g)+O2(g)═2H2O(l)△H8 |
19.硫代硫酸钠(Na2S2O3)俗称大苏打,是一种重要的工业试剂.某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录(见表格),请结合表中信息,回答有关问题:(反应原理Na2S2O3+H2SO4═Na2SO4+H2O+SO2↑+S↓)
(1)在上述实验中,反应速率最快的可能是D(填实验序号).
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是BD(填实验序号,下同);
②A和B的组合比较,所研究的是浓度因素对速率的影响,与该组合研究问题相同的组合是AC
③B和C的组合比较,所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度.
(3)实验中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较(写出一个理由即可)SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
| 实验序号 | 反应温度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是BD(填实验序号,下同);
②A和B的组合比较,所研究的是浓度因素对速率的影响,与该组合研究问题相同的组合是AC
③B和C的组合比较,所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度.
(3)实验中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较(写出一个理由即可)SO2可溶于水,测定不精确或实验装置较复杂,不易控制.