题目内容
17.向 50mL 18mol/L 的浓硫酸中加入足量的铜片并加热,充分反应后,待溶液冷却后加入足量BaCl2 溶液,生成沉淀的物质的量是( )| A. | 等于0.9mol | B. | 等于0.45mol | C. | 小于0.45 mol | D. | 大于0.45 mol |
分析 加热条件下,浓硫酸和铜发生反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(H2SO4)=18mol/L×0.05L=0.9mol,稀硫酸和Cu不反应铜与浓硫酸反应,结合硫酸铜、硫酸都能与氯化钡反应生成硫酸钡解答.
解答 解:加热条件下,浓硫酸和铜发生反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(H2SO4)=18mol/L×0.05L=0.9mol,该反应中有一半的浓硫酸被还原,当浓硫酸浓度降为一定浓度时变为稀硫酸,稀硫酸和Cu不反应,所以被还原的硫酸的物质的量小于0.45mol,则生成的硫酸铜和剩余硫酸的物质的量之和大于0.45mol,1mol硫酸铜和1mol硫酸都能与氯化钡反应生成1mol硫酸钡,所以反应生成硫酸钡物质的量大于0.45 mol,
故选:D.
点评 本题考查铜和浓硫酸的反应,明确浓硫酸和铜反应而稀硫酸和铜不反应是解本题关键,注意硫原子个数守恒的运用,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
7.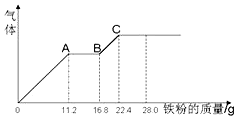 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原溶液中H2SO4浓度为4mol•L-1 | |
| B. | 图中,AB段的反应为2Fe3++Fe=3Fe2+,A点的溶质为Fe(NO3)3 | |
| C. | 原混合液中NO3-的物质的量为0.4mol | |
| D. | 图中,OA段产生是NO,BC段产生的气体是氢气 |
8.下列事实不能用元素周期律解释的是( )
| A. | 碱性:KOH>NaOH | B. | 相对分子质量:Ar>K | ||
| C. | 酸性:HClO4>H2SO4 | D. | 元素的金属性:Mg>Al |
12.X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数).下列说法正确的是( )
| A. | 若Y(OH)n为强碱,则X(OH)n也一定为强碱 | |
| B. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| C. | 若X元素形成的单质是X2,则Y元素形成的单质一定是Y2 | |
| D. | 若X的最高正价为+m,则Y的最高正价一定为+m |
2.下列变化中可以说明SO2具有漂白性的是( )
| A. | SO2通入酸性高锰酸钾溶液中红色褪去 | |
| B. | SO2通入品红溶液红色褪去 | |
| C. | SO2通入溴水溶液中红棕色褪去 | |
| D. | SO2通入氢氧化钠与酚酞的混合溶液红色褪去 |
9.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A. | 在自然界中只以化合态的形式存在,形成的单质是良好的半导体材料 | |
| B. | 单质常用作半导体材料和光导纤维 | |
| C. | 最高价氧化物是酸性氧化物,不能与酸反应 | |
| D. | 最高价氧化物对应的水化物的酸性比磷酸强 |
6.下列图中的实验方案,能达到实验目的是( )
| A. |  可用于制取少量NH3或用MnO2和浓盐酸制取Cl2 | |
| B. |  可用于制取乙烯并检验乙烯 | |
| C. |  可以验证FeCl3对H2O2分解反应有催化作用 | |
| D. |  先从①口进气集满CO2,再从②口进气,可用于收集NO |
18.下列实验中,所采取的分离方法不正确的是( )
| 选项 | 目的 | 分离方法 |
| A | 除去铜器表面的铜绿[Cu2(OH)2CO3] | 用盐酸浸泡,再用清水冲洗 |
| B | 除去乙醇中的少量水 | 加生石灰,再蒸馏 |
| C | 除去苯中含有苯酚杂质 | 加入溴水,过滤 |
| D | 除去NaCl固体中的NH4Cl | 加热 |
| A. | A | B. | B | C. | C | D. | D |