题目内容
 以CO2与H2为原料还可合成液体燃料甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.现将1mol CO2和3mol H2充入容积为2L的密闭容器中发生上述反应,下列说法正确的是( )
以CO2与H2为原料还可合成液体燃料甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.现将1mol CO2和3mol H2充入容积为2L的密闭容器中发生上述反应,下列说法正确的是( )| A、若保持恒温,当容器中n(CH3OH):n(H2O)为1:1时,该反应已达平衡状态 |
| B、若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态 |
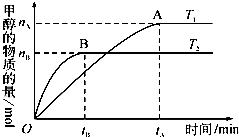
| C、若其他条件不变,实验结果如图所示,则平衡常数:K(T1)<K(T2) |
| D、保持温度不变,当反应已达平衡时,若向容器中再充入1 mol CO2和3 mol H2,当达到新平衡时,n(CH3OH):n(H2)将升高 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、无论反应是否达到平衡状态,n(CH3OH):n(H2O)为1:1;
B、当反应前后改变的物理量不变时,该反应达到平衡状态;
C、根据“先拐先平数值大”判断;
D、保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡向气体体积减小的方向移动.
B、当反应前后改变的物理量不变时,该反应达到平衡状态;
C、根据“先拐先平数值大”判断;
D、保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡向气体体积减小的方向移动.
解答:
解:A、若保持恒温,无论该反应是否达到平衡状态,容器中n(CH3OH):n(H2O)始终为1:1,所以不能据此判断平衡状态,故错误;
B、该反应是反应气体体积减小的反应,若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态,故正确;
C、根据“先拐先平数值大”知T1<T2,升高温度,甲醇的物质的量减小,则平衡向逆反应发现移动,所以平衡常数:K(T1)>K (T2),故错误;
D、保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡向正反应方向移动,且反应物的转化为大于原来平衡转化率,所以当达到新平衡时,n(CH3OH):n(H2)将升高,故正确;
故选BD.
B、该反应是反应气体体积减小的反应,若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态,故正确;
C、根据“先拐先平数值大”知T1<T2,升高温度,甲醇的物质的量减小,则平衡向逆反应发现移动,所以平衡常数:K(T1)>K (T2),故错误;
D、保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO2和3mol H2,相当于增大压强,平衡向正反应方向移动,且反应物的转化为大于原来平衡转化率,所以当达到新平衡时,n(CH3OH):n(H2)将升高,故正确;
故选BD.
点评:本题主要考查了化学平衡以及平衡图象的知识点,根据化学平衡的判断方法等知识点来分析解答,本知识点是高考热点,题目难度中等.

练习册系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的,且实验装置正确的是( )


| A、图1所示装置,检验碳酸钾中钾元素的存在 |
| B、图2所示装置,称量少量氢氧化钠固体 |
| C、图3所示装置,分离CCl4萃取溴水后所得的有机层和水层 |
| D、图4所示装置,分离沸点相差较大的酒精、水的混合物 |
下列说法正确的是( )
| A、在由水电离产生的氢离子浓度为10-13 mol?L-1的溶液中,Ca2+、K+、Cl-、HCO3-四种离子能大量共存 |
| B、已知MgCO3的Ksp═6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)═6.82×10-6 |
| C、对于反应2N2H4(l)=N2(g)+2H2(g)△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
| D、常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
 某同学按如图所示的装置进行试验.A、B 为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处 SO42-从右向左移动.下列分析错误的是( )
某同学按如图所示的装置进行试验.A、B 为两种常见金属,它们的硫酸盐可溶于水.当 K 闭合时,在交换膜处 SO42-从右向左移动.下列分析错误的是( )| A、金属活动性A强于B |
| B、B 的电极反应:B-2e一=B2+ |
| C、x电极上有 H2 产生,发生氧化反应 |
| D、反应初期,x 电极周围出现白色沉淀,不久沉淀溶解 |
现有3组混合物:①碘和氯化钠溶液 ②汽油和柴油 ③苯和水,正确的分离方法依次是( )
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、萃取 |
| D、蒸馏、萃取、分液 |
室温下,某溶液中由水电离出的c(OH-)=10-5 mol?L-1,则其溶质可能是( )
| A、CH3COOH |
| B、H2SO4 |
| C、NaOH |
| D、Na2CO3 |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: