题目内容
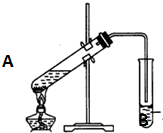 实验室用一定比例的乙醇、乙酸和浓硫酸的混合液制备乙酸乙酯,装置如图所示:
实验室用一定比例的乙醇、乙酸和浓硫酸的混合液制备乙酸乙酯,装置如图所示:(1)写出生成乙酸乙酯的化学方程式:
(2)B试管中加入饱和碳酸钠的作用是:
(3)其中导管要插在液面上而不能插入溶液中,目的是
(4)实验完成后,试管B的液面上有透明的不溶于水的油状液体产生.若分离10mL该液体混合物需要用到的主要玻璃仪器是
考点:乙酸乙酯的制取
专题:有机物的化学性质及推断
分析:(1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(3)根据导管伸入液面下可能发生倒吸分析;
(4)分离互不相溶的液体,可用分液的方法分离.
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(3)根据导管伸入液面下可能发生倒吸分析;
(4)分离互不相溶的液体,可用分液的方法分离.
解答:
解:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:
CH3COOH+C2H5OH
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度;
(3)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:防倒吸;
(4)分离乙酸乙酯时应用的仪器是分液漏斗,先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,故答案为:分液漏斗;分液.
CH3COOH+C2H5OH
| 浓硫酸 |
| △ |
故答案为:CH3COOH+C2H5OH
| 浓硫酸 |
| △ |
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度;
(3)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:防倒吸;
(4)分离乙酸乙酯时应用的仪器是分液漏斗,先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,故答案为:分液漏斗;分液.
点评:本题考查乙酸乙酯的制备,题目难度中等,涉及的题量较大,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的,且实验装置正确的是( )


| A、图1所示装置,检验碳酸钾中钾元素的存在 |
| B、图2所示装置,称量少量氢氧化钠固体 |
| C、图3所示装置,分离CCl4萃取溴水后所得的有机层和水层 |
| D、图4所示装置,分离沸点相差较大的酒精、水的混合物 |
下列实验操作中错误的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中(放有等质量的纸) |
某气体由烯烃和炔烃混合而成,经测定其密度为同条件下H2的13.5倍,则下列说法中正确的是( )
| A、混合气体中一定没有乙炔 |
| B、混合气体中一定有乙烯 |
| C、混合气体可能由乙炔和丙烯组成 |
| D、混合气体可能由丙烯和丙炔组成 |
下列说法正确的是( )
| A、在由水电离产生的氢离子浓度为10-13 mol?L-1的溶液中,Ca2+、K+、Cl-、HCO3-四种离子能大量共存 |
| B、已知MgCO3的Ksp═6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)═6.82×10-6 |
| C、对于反应2N2H4(l)=N2(g)+2H2(g)△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
| D、常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |