题目内容
下列说法或表示正确的是( )
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 |
| C、稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ |
| D、在101kPa时,H2燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol |
考点:反应热和焓变,反应热的大小比较
专题:
分析:A、硫蒸气变化为硫固体为放热过程,结合盖斯定律分析判断;
B、物质能量越高越活泼分析;
C、浓硫酸溶解过程中放热;
D、燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量.
B、物质能量越高越活泼分析;
C、浓硫酸溶解过程中放热;
D、燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量.
解答:
解:A、硫蒸气变化为硫固体为放热过程,结合盖斯定律分析判断,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故A错误;
B、物质能量越高越活泼,由单质A转化为单质B是一个吸热过程,B的能量高,由此可知单质A比单质B稳定,故B错误;
C、浓硫酸溶解过程中放热,将含0.5molH2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ,故C正确;
D、燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,H2燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为285.8kJ/mol,故D错误;
故选C.
B、物质能量越高越活泼,由单质A转化为单质B是一个吸热过程,B的能量高,由此可知单质A比单质B稳定,故B错误;
C、浓硫酸溶解过程中放热,将含0.5molH2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ,故C正确;
D、燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,H2燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为285.8kJ/mol,故D错误;
故选C.
点评:本题考查了燃烧热、中和热概念的理解应用,物质能量越高越活泼,掌握盖斯定律的应用是关键,题目较简单.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
向含有下列离子的溶液中加入一小块金属钠,引起该离子数目减少的是( )
| A、CO32- |
| B、Cl- |
| C、OH- |
| D、HCO3- |
下列有关金属腐蚀与防护的说法正确的是( )
| A、当镀锡铁制品的镀层破损时,锡层仍能对铁制品起保护作用 |
| B、纯银器表面在空气中渐渐变暗是因为发生了化学腐蚀 |
| C、可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| D、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
Na2S2O3可用作纺织工业氯气漂白布匹后的“脱氯剂”:4C12+Na2S2O3+5H2O=2NaCl+2H2SO4+6HCl,有关该反应的叙述正确的是( )
| A、C12 是氧化剂 |
| B、H2SO4是氧化产物 |
| C、反应中S元素的价态降低 |
| D、反应中H2O被氧化 |
如图所示与对应的叙述相符的是( )
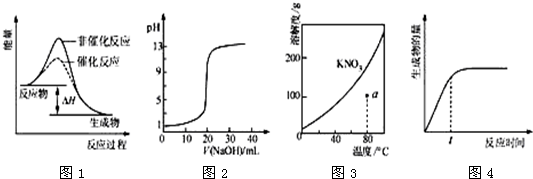

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D、图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正>v逆 |
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素.下列叙述正确的是( )
| A、四种元素的原子半径:A>B>C>D |
| B、最高价氧化物对应的水化物的酸性:B>D |
| C、C元素处于元素周期表中第3周期第ⅡA族 |
| D、B、D的最高价氧化物中,B、D与氧原子之间一定均为单键 |
下列化学用语正确的是( )
A、聚丙烯的结构简式: |
B、丙烷分子的比例模型: |
C、四氯化碳的电子式: |
D、3-甲基-1-丁烯分子的键线式: |
设N表示阿伏加德罗常数的值,则下述不正确的是( )
| A、1molC670H1342中含有的共价键数为2011N |
| B、12g金刚石中的碳碳单键数为2N |
| C、48g O2与O3混合气体中含氧原子个数为3N |
| D、78g过氧化钠晶体中离子总数为4N |