题目内容
如图所示与对应的叙述相符的是( )
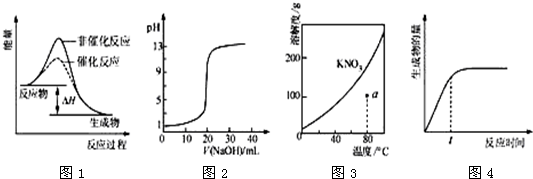

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D、图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正>v逆 |
考点:反应热和焓变,溶液中溶质的质量分数及相关计算,化学平衡的影响因素,酸碱混合时的定性判断及有关ph的计算
专题:图示题
分析:A、由图1可知,反应物的总能量高于生成物的总能量;虚线表示的活化能降低,为使用催化剂;
B、强碱滴定醋酸溶液时,醋酸是弱酸不能完全电离;
C、硝酸钾的溶解度随着温度的升高而增大;
D、t时刻时,反应正向进行而且没有达到平衡状态.
B、强碱滴定醋酸溶液时,醋酸是弱酸不能完全电离;
C、硝酸钾的溶解度随着温度的升高而增大;
D、t时刻时,反应正向进行而且没有达到平衡状态.
解答:
解:A、由图1可知,反应物的总能量高于生成物的总能量,故反应放热反应;虚线表示的活化能降低,为使用催化剂,表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化,故A错误;
B、强碱强氧化钠滴定醋酸溶液时,开始20.00mL0.1000mol?L-1CH3COOH溶液pH大于1,故B错误;
C、硝酸钾的溶解度随着温度的升高而增大,溶解度曲线下方的点是不饱和溶液的点,故C正确;
D、图4表示某可逆反应生成物的量随反应时间变化的曲线,t时刻时,反应正向进行而且没有达到平衡状态,所以v正>v逆,故D正确.
故选CD.
B、强碱强氧化钠滴定醋酸溶液时,开始20.00mL0.1000mol?L-1CH3COOH溶液pH大于1,故B错误;
C、硝酸钾的溶解度随着温度的升高而增大,溶解度曲线下方的点是不饱和溶液的点,故C正确;
D、图4表示某可逆反应生成物的量随反应时间变化的曲线,t时刻时,反应正向进行而且没有达到平衡状态,所以v正>v逆,故D正确.
故选CD.
点评:本题考查了催化剂对反应活化能的影响、滴定图象、外界条件对平衡移动的影响等,注意识图能力是解决问题的关键,考查学生对质的梳理和归纳能力,综合性较强,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于下列各图的叙述正确的是( )
A、 a、b曲线分别表示反应CH3CH3(g)→CH2=CH2(g)+H2(g)(△H>0),使用和未使用催化剂时,反应过程中的能量变化 |
B、 表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C、 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A |
D、 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
下列关于铜电极的叙述正确的是( )
| A、铜锌原电池中铜是阳极 |
| B、用电解法精炼粗铜时纯铜作阳极 |
| C、在镀件上电镀铜时可用金属铜作阳极 |
| D、氯碱工业中用铜作阳极 |
下列反应中,氯元素全部被氧化的是( )
| A、2P+3Cl2═2PCl3 | ||||
B、2NaCl
| ||||
| C、NaOH+HCl═NaCl+H2O | ||||
| D、2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O |
氧化还原反应的实质是( )
| A、原子重新组合 |
| B、有氧元素参加 |
| C、元素化合价发生变化 |
| D、电子的转移(得失或偏移) |
下列说法或表示正确的是( )
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 |
| C、稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ |
| D、在101kPa时,H2燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、64g SO2含有氧原子数为NA |
| B、物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA |
| C、标准状况下,22.4L CCl4的分子数为NA |
| D、常温常压下,14g N2含有分子数为0.5NA |
