题目内容
下列离子方程式与所述事实相符且正确的是( )
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| B、Ca(HCO3)2溶液中加入足量NaOH溶液:HCO3-+OH-=H2O+CO32- |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| D、氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
考点:离子方程式的书写
专题:
分析:A.二者反应生成碳酸钙和次氯酸;
B.二者反应生成碳酸钙、碳酸钠和水;
C.二者反应生成碳酸氢钠和氢氧化铝沉淀;
D.二者反应生成氢氧化镁、碳酸钙沉淀和水.
B.二者反应生成碳酸钙、碳酸钠和水;
C.二者反应生成碳酸氢钠和氢氧化铝沉淀;
D.二者反应生成氢氧化镁、碳酸钙沉淀和水.
解答:
解:A.二者反应生成碳酸钙和次氯酸2ClO-+CO2+Ca2++H2O═2HClO+CaCO3↓,故A错误;
B.二者反应生成碳酸钙、碳酸钠和水,离子方程式为Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32,故B错误;
C.二者反应生成碳酸氢钠和氢氧化铝沉淀,离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C正确;
D.二者反应生成氢氧化镁、碳酸钙沉淀和水,离子方程式为Mg2++Ca2++3OH-+HCO3-=CaCO3↓+H2O+Mg(OH)2↓,故D错误;
故选C.
B.二者反应生成碳酸钙、碳酸钠和水,离子方程式为Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32,故B错误;
C.二者反应生成碳酸氢钠和氢氧化铝沉淀,离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故C正确;
D.二者反应生成氢氧化镁、碳酸钙沉淀和水,离子方程式为Mg2++Ca2++3OH-+HCO3-=CaCO3↓+H2O+Mg(OH)2↓,故D错误;
故选C.
点评:本题考查离子方程式正误判断,明确物质的性质及离子反应条件是解本题关键,易错选项是D,注意氢氧化镁的溶解性小于碳酸镁,题目难度中等.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
下列有关实验的叙述中,合理的是( )
①用pH试纸测得某新制氯水的pH为2
②将纯碱溶于热水中清洗油污,可以增强去污效果
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,则测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度.
①用pH试纸测得某新制氯水的pH为2
②将纯碱溶于热水中清洗油污,可以增强去污效果
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,则测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度.
| A、②④⑥ | B、②③⑥ |
| C、①②④ | D、②③④⑤⑥ |
下列说法正确的是( )
| A、电子在核外运动时有确定的轨道和轨迹,电子云就是对其运动轨迹的准确描述 |
| B、原子核外电子在某一时刻的位置可以测定或计算出来 |
| C、人们常用小黑点的疏密程度来表示电子在原子核外出现的概率的大小 |
| D、电子云图中的小黑点表示电子的个数多少 |
已知NA为阿佛加德罗常数,下列有关叙述中正确的是( )
| A、已知有2mol Na218O2与足量的CO2充分反应,生成的碳酸钠中含18O的原子为NA个 |
| B、电解精炼镍时,当电源提供NA个电子时,阳极溶解的Ni2+应为0.5mol |
| C、标准状况下,22.4L SO2和O2的混合气体中含有的氧原子数为2NA |
| D、向足量MnO2中加入溶有4mol HCl的浓盐酸,加热,反应后的溶液中的Cl-数是2NA个(不考虑盐酸的挥发) |
下列物质的分类结果全部正确的是( )
| A、CO-酸性氧化物 Na2O-碱性氧化物 Al2O3-两性氧化物 |
| B、汽油-混合物 胆矾-纯净物 HD-单质 |
| C、苏打-碱 硫化氢-酸 小苏打-酸式盐 |
| D、液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
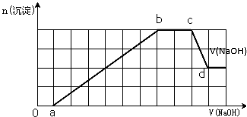

| A、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| C、原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种 |
| D、d点溶液中含有的溶质只有Na2SO4 |
