题目内容
6.下列实验用来证明气体SO2的存在,其中正确的是( )①能使品红溶液褪色
②能使湿润的蓝色石蕊试纸变红
③能使澄清的石灰水变浑浊
④通入足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸
⑤通入到溴水使其褪色,再滴入Ba(NO3)2溶液,有白色沉淀生成.
| A. | ①②④⑤ | B. | 都不能证明 | C. | ①⑤能证明 | D. | 只有⑤能证明 |
分析 SO2是酸性氧化物,其水溶液呈酸性;S元素化合价处于中间价态,SO2既有氧化性又有还原性;SO2还能和有色物质反应生成无色物质而具有漂白性,以此解答该题.
解答 解:①能使品红溶液褪色 的不一定为二氧化硫,可为氯气等,故错误;
②能使湿润的蓝色石蕊试纸变红的为酸性气体,不一定为二氧化硫,故错误;
③能使澄清的石灰水变浑浊也可能为二氧化碳等,故错误;
④通入足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸,不一定为二氧化硫,也可能为二氧化碳,故错误;
⑤通入溴水,溴水褪色,再加入Ba(NO3)2溶液有白色沉淀生成,白色沉淀为硫酸钡,则使溴水褪色的气体为二氧化硫,二氧化硫与溴水发生氧化还原反应,故正确.
故选D.
点评 本题考查二氧化硫性质,为高频考点,注意二氧化硫、二氧化碳性质差异性是解本题关键,注意二氧化硫漂白性和次氯酸漂白性区别,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.对于0.1mol/L Na2SO3溶液,下列叙述正确的是( )
| A. | c(Na+):c(SO32-)<2:1 | |
| B. | c(Na+)=2 c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=2 c(SO32-)+2 c(HSO3-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(SO32-) 与c(Na+) 均增大 |
17.久置空气中会发生颜色变化,但颜色变化不是由于跟氧气反应引起的是( )
| A. | 过氧化钠固体 | B. | 苯酚晶体 | C. | 硫酸亚铁晶体 | D. | 亚硫酸钠固体 |
14.NA表示阿伏伽德罗常数,某氯气样品由37Cl2分子组成,下列说法正确的是( )
| A. | 37g该氯气样品含NA个氯气分子 | |
| B. | 11.2L该氯气样品质量是37g | |
| C. | 37g该氯气样品与足量NaOH完全反应生成Na37Cl和Na37ClO3,氧化剂和还原剂的质量之比为5:1 | |
| D. | 0.1NA个氯气分子溶于水形成1000mL溶液,溶液中c(Cl-)=0.2mol/L |
1.下列属于碱性氧化物的是( )
| A. | CaO | B. | Na2O2 | C. | SiO2 | D. | Mn2O7 |
11.下列化学用语正确的是( )
| A. | 乙烯的结构简式:C2H4 | B. | NaH中氢离子的结构示意图: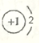 | ||
| C. | NH4I的电子式: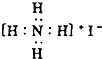 | D. | H2O、CO2的比例模型都可以用 表示 表示 |
18. 如图所示装置中,M为活动性顺序位于氢之前的金属,N为石墨棒.关于此装置的下列叙述中,不正确的是( )
如图所示装置中,M为活动性顺序位于氢之前的金属,N为石墨棒.关于此装置的下列叙述中,不正确的是( )
 如图所示装置中,M为活动性顺序位于氢之前的金属,N为石墨棒.关于此装置的下列叙述中,不正确的是( )
如图所示装置中,M为活动性顺序位于氢之前的金属,N为石墨棒.关于此装置的下列叙述中,不正确的是( )| A. | N上有气体放出 | |
| B. | M为负极,N为正极 | |
| C. | 导线中有电流通过,电流方向是由M到N | |
| D. | 该装置是化学能转变为电能的装置 |
8.实验室中,下列药品保存方法正确的是( )
①白磷保存在冷水中
②钠,钾保存在水里
③HF溶液保存在塑料瓶中
④Na2CO3溶液保存在带橡胶塞的试剂瓶内
⑤浓硝酸保存在棕色广口瓶内.
①白磷保存在冷水中
②钠,钾保存在水里
③HF溶液保存在塑料瓶中
④Na2CO3溶液保存在带橡胶塞的试剂瓶内
⑤浓硝酸保存在棕色广口瓶内.
| A. | ①③④ | B. | ③④ | C. | ①②③④ | D. | ①②③④⑤ |
9.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 44g N2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L N2含有的分子数目为NA | |
| C. | lmol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | 由CO2和O2组成的混合气体中共有NA个分子,其中的氧分子数为2NA |