题目内容
14.NA表示阿伏伽德罗常数,某氯气样品由37Cl2分子组成,下列说法正确的是( )| A. | 37g该氯气样品含NA个氯气分子 | |
| B. | 11.2L该氯气样品质量是37g | |
| C. | 37g该氯气样品与足量NaOH完全反应生成Na37Cl和Na37ClO3,氧化剂和还原剂的质量之比为5:1 | |
| D. | 0.1NA个氯气分子溶于水形成1000mL溶液,溶液中c(Cl-)=0.2mol/L |
分析 A.依据N=$\frac{m}{M}$×NA计算;
B.气体状况未知;
C.依据337Cl2+6NaOH(热)=Na37Cl+5Na37ClO3+3H20分析解答;
D.氯气溶于水,部分与水反应生成氯化氢和次氯酸,部分以氯气分子形式存在.
解答 解:A.37g该氯气样品含氯气分子数为:$\frac{37g}{74g/mol}$×NA=0.5NA,故A错误;
B.气体状况未知,气体摩尔体积未知,无法计算氯气物质的量和质量,故B错误;
C.337Cl2+6NaOH(热)=Na37Cl+5Na37ClO3+3H20,反应中有6mol37Cl参加反应,其中有1mol化合价降低,5mol化合价升高,所以氧化剂和还原剂的质量之比为5:1,故C正确;
D.氯气溶于水,部分与水反应生成氯化氢和次氯酸,部分以氯气分子形式存在,所以0.1NA个氯气分子溶于水形成1000mL溶液,c(Cl-)<0.2mol/L,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,明确相关公式及氧化还原反应相关概念是解题关键,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
5.下列有关氧化还原反应的说法正确的是( )
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 还原剂得电子总数与氧化剂失电子总数相等 | |
| C. | 氧化还原反应中的反应物,不是氧化剂就是还原剂 | |
| D. | 非金属元素的最高价氧化物的水化物不一定都具有强氧化性 |
2.某原电池的总反应为:2FeCl3+Fe→3FeCl2,则以下叙述正确的是( )
| A. | 铁作阳极 | B. | 炭棒作阴极 | ||
| C. | 正极反应式为Fe3++e-→Fe2+ | D. | 负极反应式为Fe2+-e-→Fe3+ |
9.用下列实验装置进行相应实验,能达到实验目的是( )
| A. |  配制一定物质的量浓度的稀硫酸 | B. | 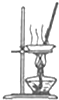 蒸发NH4Cl饱和溶液制备NH4Cl晶体 | ||
| C. | 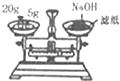 称量NaOH固体 | D. | 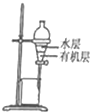 萃取后有机层从下口排放 |
19.下列解释事实或实验现象的化学用语正确的是( )
| A. | 将Cl2通入水中形成的溶液呈酸性 Cl2+H2O═2 H++Cl-+ClO- | |
| B. | 淀粉碘化钾溶液在空气中变蓝 4 I-+O2+2 H2O═2 I2+4 OH- | |
| C. | 钢铁表面的水膜酸性较强时,水膜中的H+会被还原 O2+4 H++4 e-═2 H2O | |
| D. | 向Na2SiO3溶液中通入过量SO2,有胶状物质生成SiO32-+SO2+H2O═H2SiO3↓+SO32- |
6.下列实验用来证明气体SO2的存在,其中正确的是( )
①能使品红溶液褪色
②能使湿润的蓝色石蕊试纸变红
③能使澄清的石灰水变浑浊
④通入足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸
⑤通入到溴水使其褪色,再滴入Ba(NO3)2溶液,有白色沉淀生成.
①能使品红溶液褪色
②能使湿润的蓝色石蕊试纸变红
③能使澄清的石灰水变浑浊
④通入足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸
⑤通入到溴水使其褪色,再滴入Ba(NO3)2溶液,有白色沉淀生成.
| A. | ①②④⑤ | B. | 都不能证明 | C. | ①⑤能证明 | D. | 只有⑤能证明 |
17.常温下0.1mol/L氨水溶液的pH=a,下列能使溶液pH=(a-1)的措施是( )
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的氯化铵固体 | ||
| C. | 加入等体积0.1 mol/L烧碱溶液 | D. | 加入等体积0.1 mol/L盐酸 |