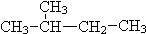题目内容
火箭升空使用肼(N2H4)作为燃料,N2O4为氧化剂.
(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
气态肼在N2O4中燃烧生成氮气和水蒸气的热化学方程式为 .
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为 .
(3)一定条件下,向2L密闭容器中充入3.2molNH3和4.4molO2,发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0.测得平衡时数据如下表所示:

①T1℃时,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)= ,该反应的化学平衡常数K= .
②T1 T2(填“>”、“<”或“=”).
③下列既能提高NH3的转化率,又能加快反应速率的措施是 (填选项字母).
a、升高温度 b、降低温度 c、扩大容器体积 d、体积不变的条件下再充入一定量O2
(4)在载人航天器的生态系统中,可利用电化学装置发生反应:2CO2=2CO+O2分解除去CO2,并提供充足的O2.已知该反应的阳极反应式为4OH--4e-=O2↑+2H2O,则阴极反应式为 .有人提出,可以设计反应2CO(g)=2C(s)+O2(g)△H>0来消除CO的污染,请判断上述设计是否合理 (填“是”或“否”),理由为 .
(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
气态肼在N2O4中燃烧生成氮气和水蒸气的热化学方程式为
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为
(3)一定条件下,向2L密闭容器中充入3.2molNH3和4.4molO2,发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0.测得平衡时数据如下表所示:

①T1℃时,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)=
②T1
③下列既能提高NH3的转化率,又能加快反应速率的措施是
a、升高温度 b、降低温度 c、扩大容器体积 d、体积不变的条件下再充入一定量O2
(4)在载人航天器的生态系统中,可利用电化学装置发生反应:2CO2=2CO+O2分解除去CO2,并提供充足的O2.已知该反应的阳极反应式为4OH--4e-=O2↑+2H2O,则阴极反应式为
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,化学平衡状态的判断,电解原理
专题:
分析:(1)依据热化学方程式和盖斯定律计算得到所得热化学方程式;
(2)次氯酸钠与过量的氨反应制备肼,生成氯化钠和水;结合原子守恒配平书写得到化学方程式;
(3)①依据化学平衡三段式列式计算,反应速率=
,平衡常数
;
②结合图表数据计算平衡常数,利用平衡常数变化分析温度变化;
③4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,既能提高NH3的转化率,又能加快反应速率的措施是根据平衡移动原理和影响反应速率因素分析选项判断;
(4)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;根据△G的大小判断反应能否进行.
(2)次氯酸钠与过量的氨反应制备肼,生成氯化钠和水;结合原子守恒配平书写得到化学方程式;
(3)①依据化学平衡三段式列式计算,反应速率=
| △c |
| △t |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
②结合图表数据计算平衡常数,利用平衡常数变化分析温度变化;
③4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,既能提高NH3的转化率,又能加快反应速率的措施是根据平衡移动原理和影响反应速率因素分析选项判断;
(4)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;根据△G的大小判断反应能否进行.
解答:
解:(1)已知:①N2(g)+2O2(g)=2NO(g)△H=+67.7kJ?mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
依据盖斯定律计算②×2-①-③得到气态肼在N2O4中燃烧生成氮气和水蒸气的热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ?mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ?mol-1;
(2)次氯酸钠与过量的氨反应制备肼,生成氯化钠和水,反应的化学方程式为:NaClO+2NH3=NaCl+N2H4+H2O;
故答案为:NaClO+2NH3=NaCl+N2H4+H2O;
(3)①T1时,向2L密闭容器中充入3.2molNH3和4.4molO2,发生反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0:
起始量(mol/L) 1.6 2.2 0 0
变化量(mol/L) 0.8 1 0.8 1.2
平衡量(mol/L) 0.8 1.2 0.8 1.2
T1℃时,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)=
=0.08 mol?L-1?min-1,平衡常数K=
=1.2;
故答案为:0.08 mol?L-1?min-1;1.2;
②T2时,向2L密闭容器中充入3.2molNH3和4.4molO2,发生反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0:
起始量(mol/L) 1.6 2.2 0 0
变化量(mol/L) 0.6 0.75 0.6 0.9
平衡量(mol/L) 1 1.45 0.6 0.9
K=
=0.36<1.2
则反应逆向进行,反应是放热反应,升温平衡逆向进行,T2>T1;
故答案为:<;
③4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,既能提高NH3的转化率,又能加快反应速率的措施是根据平衡移动原理和影响反应速率因素分析选项判断;
a、反应是放热反应,升高温度平衡逆向进行,故a不符合;
b、降低温度平衡正向进行,氨气转化率增大,反应速率减小,故b不符合;
c、扩大容器体积压强减小,平衡正向进行,氨气转化率增大,反应速率减小,故c不符合;
d、体积不变的条件下再充入一定量O2,平衡正向进行,氨气转化率增大,反应速率增大,故d符合;
故答案为:d;
(4)依据总反应2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T?△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行;
故答案为:2CO2+4e-+2H2O=2CO+4OH-;否,该反应为△H>0、△S<0的反应,不能自发进行.
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
依据盖斯定律计算②×2-①-③得到气态肼在N2O4中燃烧生成氮气和水蒸气的热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ?mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0 kJ?mol-1;
(2)次氯酸钠与过量的氨反应制备肼,生成氯化钠和水,反应的化学方程式为:NaClO+2NH3=NaCl+N2H4+H2O;
故答案为:NaClO+2NH3=NaCl+N2H4+H2O;
(3)①T1时,向2L密闭容器中充入3.2molNH3和4.4molO2,发生反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0:
起始量(mol/L) 1.6 2.2 0 0
变化量(mol/L) 0.8 1 0.8 1.2
平衡量(mol/L) 0.8 1.2 0.8 1.2
T1℃时,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)=
| 0.8mol/L |
| 10min |
| 1.26×0.84 |
| 0.84×1.25 |
故答案为:0.08 mol?L-1?min-1;1.2;
②T2时,向2L密闭容器中充入3.2molNH3和4.4molO2,发生反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0:
起始量(mol/L) 1.6 2.2 0 0
变化量(mol/L) 0.6 0.75 0.6 0.9
平衡量(mol/L) 1 1.45 0.6 0.9
K=
| 0.96×0.64 |
| 14×1.455 |
则反应逆向进行,反应是放热反应,升温平衡逆向进行,T2>T1;
故答案为:<;
③4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,既能提高NH3的转化率,又能加快反应速率的措施是根据平衡移动原理和影响反应速率因素分析选项判断;
a、反应是放热反应,升高温度平衡逆向进行,故a不符合;
b、降低温度平衡正向进行,氨气转化率增大,反应速率减小,故b不符合;
c、扩大容器体积压强减小,平衡正向进行,氨气转化率增大,反应速率减小,故c不符合;
d、体积不变的条件下再充入一定量O2,平衡正向进行,氨气转化率增大,反应速率增大,故d符合;
故答案为:d;
(4)依据总反应2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T?△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行;
故答案为:2CO2+4e-+2H2O=2CO+4OH-;否,该反应为△H>0、△S<0的反应,不能自发进行.
点评:本题考查较为综合,涉及反应速率、平衡常数、平衡移动以及电化学等知识,题目难度中等,注意把握影响平衡移动的因素以及平衡移动方向的判断.

练习册系列答案
相关题目
两种短周期元素X和Y形成的单质能与氢气反应生成HX和HY,反应热分别为△H1和△H2,已知△H1>△H2,则判断一定正确的是( )
| A、沸点:HY>HX |
| B、还原性:HY>HX |
| C、稳定性:HY>HX |
| D、酸性:HXO4>HYO4 |
下列有关叙述:能说明非金属元素M比N的非金属性强的是( )
①非金属单质M能从N的盐溶液中置换出非金属单质N;
②M原子比N原子容易得到电子;
③单质M形成的气态氢化物比N形成的气态氢化物稳定;
④气态氢化物水溶液的酸性HmM>HnN;
⑤氧化物对应水化物的酸性HmMOx>HnNOy;
⑥熔点M>N.
①非金属单质M能从N的盐溶液中置换出非金属单质N;
②M原子比N原子容易得到电子;
③单质M形成的气态氢化物比N形成的气态氢化物稳定;
④气态氢化物水溶液的酸性HmM>HnN;
⑤氧化物对应水化物的酸性HmMOx>HnNOy;
⑥熔点M>N.
| A、②⑤ | B、①②③ |
| C、①②③⑤ | D、全部 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8g CH4含有4NA个氢原子 |
| B、1L 0.1 mol?L-1 (NH4)2SO4溶液中含有0.2NA个NH4+ |
| C、1mol Cu与足量FeCl3溶液反应,转移2NA个电子 |
| D、标准状况下,2.24L氮气含有0.1NA个N2分子 |
下列各项中所列举的物质与所属类别对应不正确的是( )
| A、酸性氧化物:CO2,SO2,SiO2,Cl2O7 |
| B、非电解质:乙醇、四氯化碳、氯气、葡萄糖 |
| C、同素异形体:活性炭、C60、石墨、金刚石 |
| D、混合物:铝热剂、纯净矿泉水、水玻璃、焦炉气 |
下列有关电化学装置的叙述正确的是( )
A、 Zn、MnO2干电池放电时MnO2被氧化 Zn、MnO2干电池放电时MnO2被氧化 |
B、 电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等 电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等 |
C、 K分别于M、N连接,均可保护Fe电极,且都称为“牺牲阳极的阴极保护法” K分别于M、N连接,均可保护Fe电极,且都称为“牺牲阳极的阴极保护法” |
D、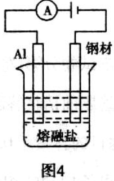 在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl3-,形式存在,则阳极反应式为:Al-3e-+7AlCl4-=4Al2Cl3- 在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl3-,形式存在,则阳极反应式为:Al-3e-+7AlCl4-=4Al2Cl3- |
 和
和 ; ⑥
; ⑥ 和
和 ⑦CH3(CH2)3CH3和
⑦CH3(CH2)3CH3和