题目内容
1.根据元素所在元素周期表的位置,判断下列元素都能作为半导体材料的是( )| A. | S、K | B. | C、Al | C. | Si、Ge | D. | Ag、Cu |
分析 半导体材料元素既有金属性,又有非金属性,导电性介于导体与绝缘体之间,应在金属与非金属交界处.
解答 解:A.S为绝缘体,故A错误;
B.C、Al都是导体,故B错误;
C.Si、Ge在在金属与非金属交界处,既有金属性,又有非金属性,所以是半导体材料,故C正确;
D.Ag、Cu都是导体,故D错误;
故选:C.
点评 本题考查了学生对元素周期表的熟悉程度,明确位置与性质的关系是解答的关键,题目难度不大.

练习册系列答案
相关题目
20.为了高效解决化石燃料燃烧存在的问题,不需要研究的问题有( )
| A. | 杜绝化石燃料的使用,从源头上解决问题 | |
| B. | 减少燃料燃烧产生的热量损耗的技术,提高燃料利用率的措施 | |
| C. | 防止燃料燃烧造成环境污染的方法 | |
| D. | 通过化学方法把化石燃料转化成洁净燃料 |
1.资料显示:O2的氧化性随溶液pH的增大逐渐减弱.室温下,某学习小组利用下图装置探究不同条件下KI与O2的反应,实验记录如下.
回答下列问题:
(1)实验③的目的是验证Cl-是否影响KI与O2的反应.
(2)实验②中发生反应的离子方程式是4I-+O2+4H+=2I2+2H2O.
(3)实验②比实验④溶液颜色深的原因是其他条件相同时,HCl是强电解质,溶液中c(H+)较醋酸大,O2的氧化性较强.
为进一步探究KI与O2的反应,用上述装置继续进行实验:
对于实验⑥的现象.甲同学猜想“pH=10时O2不能氧化I-”,他设计了下列装置进行实验以验证猜想.
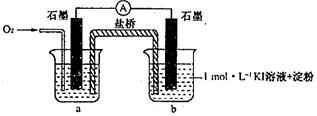
(4)烧杯a中的溶液为pH=10的KOH溶液.
(5)实验结果表明此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b中的溶液逐渐变蓝色.
(6)乙同学向pH=10的“KOH一淀粉溶液”中滴加碘水,溶液先变蓝后迅速褪色,经检测褪色后的溶液中含有IO3-,用离子方程式表示退色的原因是3I2+6OH-=IO3-+5I-+3H2O.
(7)该小组同学对实验过程进行了整体反思,推测实验①和实验⑥的现象产生的原因分别可能是中性条件下,O2的氧化性比较弱,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
| 序号 | 烧杯中的液体 | 5分钟后现象 |
| ① | 2mL 1mol•L-1KI溶液+5滴淀粉 | 无明显变化 |
| ② | 2mL1mol•L-1KI 溶液+5 滴淀粉+2mL0.2mol•L-1HC1 | 溶液变蓝 |
| ③ | 2mLl mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1KC1 | 无明显变化 |
| ④ | 2mL1mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1CH3COOH | 溶液变蓝,颜色 较②浅 |
(1)实验③的目的是验证Cl-是否影响KI与O2的反应.
(2)实验②中发生反应的离子方程式是4I-+O2+4H+=2I2+2H2O.
(3)实验②比实验④溶液颜色深的原因是其他条件相同时,HCl是强电解质,溶液中c(H+)较醋酸大,O2的氧化性较强.
为进一步探究KI与O2的反应,用上述装置继续进行实验:
| 序号 | 烧杯中的液体 | 5小时后现象 |
| ⑤ | 2mL混有KOH的pH=8.5的lmol•L-1KI溶液+5滴淀粉 | 溶液略变蓝 |
| ⑥ | 2mL混有KOH的pH=10的lmol•L-1KI溶液+5滴淀粉 | 无明显变化 |

(4)烧杯a中的溶液为pH=10的KOH溶液.
(5)实验结果表明此猜想不成立.支持该结论的实验现象是:通入O2后,电流表指针偏转,烧杯b中的溶液逐渐变蓝色.
(6)乙同学向pH=10的“KOH一淀粉溶液”中滴加碘水,溶液先变蓝后迅速褪色,经检测褪色后的溶液中含有IO3-,用离子方程式表示退色的原因是3I2+6OH-=IO3-+5I-+3H2O.
(7)该小组同学对实验过程进行了整体反思,推测实验①和实验⑥的现象产生的原因分别可能是中性条件下,O2的氧化性比较弱,短时间内难以生成“一定量”碘单质使溶液颜色发生变化;pH=10的KOH溶液中I-被氧化生成I2,I2迅速发生歧化反应变为IO3-和I-.
18.已知X+Y═M+N反应中的能量变化过程如图,则下列有关说法正确的是( )
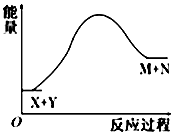

| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |
5.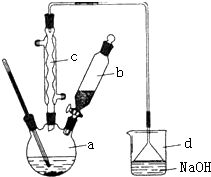 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
(1)仪器c的名称为球形冷凝管,温度计的作用是测定烧瓶内液体的温度.
(2)在a中加入30mL无水苯和少量铁屑.在b中小心加入8.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体.继续滴加至液溴滴完,装置d的作用是吸收HBr和Br2;
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入15mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2.
③向分出的粗溴苯中加入少量的无水氯化钙进行吸水干燥,静置、过滤.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质的结构简式为 ,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)在该实验中,a的容积最适合的是C(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(2)在a中加入30mL无水苯和少量铁屑.在b中小心加入8.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体.继续滴加至液溴滴完,装置d的作用是吸收HBr和Br2;
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入15mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2.
③向分出的粗溴苯中加入少量的无水氯化钙进行吸水干燥,静置、过滤.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质的结构简式为
 ,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)在该实验中,a的容积最适合的是C(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL.
10.下列各项比较中前者高于(或大于或强于)后者的是( )
| A. | 金属Mg和金属Cu的空间利用率 | |
| B. | BF3和CH4中心原子的价层电子对数 | |
| C. | 邻羟基苯甲醛(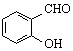 )和对羟基苯甲醛( )和对羟基苯甲醛(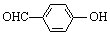 )的沸点 )的沸点 | |
| D. | C-O和Si-O的键能 |
11.下列原子或离子对应的结构示意图不正确的是( )
| A. | Be | B. | K+ | C. | Cl- | D. | N |
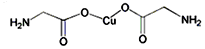
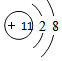 ;
; ,该物质属于离子(离子、共价)化合物,该物质溶于水会破坏离子键(离子键、共价键).
,该物质属于离子(离子、共价)化合物,该物质溶于水会破坏离子键(离子键、共价键). ,该物质属于共价(离子、共价)化合物,该物质在受热气化时化学键没有(有、没有)遭到破坏.
,该物质属于共价(离子、共价)化合物,该物质在受热气化时化学键没有(有、没有)遭到破坏.