题目内容
11.下列原子或离子对应的结构示意图不正确的是( )| A. | Be | B. | K+ | C. | Cl- | D. | N |
分析 A.L层最多容纳2个电子;
B.钾离子的核电荷数为19,核外电子总数为18;
C.氯离子的核电荷数为17,核外电子总数为18,最外层含有8个电子;
D.N原子的核电荷数=核外电子总数=7,最外层含有5个电子.
解答 解:A.Be的核电荷数为4,核外含有2个电子层,正确的原子结构示意图为: ,故A错误;
,故A错误;
B.K+的核电荷数为19,核外电子总数为18,最外层达到8电子稳定结构,其离子结构示意图为: ,故B正确;
,故B正确;
C.Cl-的核外电子总数为18,其离子结构示意图为: ,故C正确;
,故C正确;
D.N的核电荷数、核外电子总数都是7,其原子结构示意图为: ,故D正确;
,故D正确;
故选A.
点评 本题考查原子结构示意图的判断,题目难度不大,明确原子结构示意图的表示方法为解答关键,注意明确离子与原子结构示意图的区别,试题培养了学生的规范答题能力.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
1.根据元素所在元素周期表的位置,判断下列元素都能作为半导体材料的是( )
| A. | S、K | B. | C、Al | C. | Si、Ge | D. | Ag、Cu |
2.下列说法正确的是( )
| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | 碱金属元素单质都能保存于煤油中 | |
| C. | 卤族元素单质的熔、沸点随原子序数的增大而升高而碱金属元素单质的熔、沸点随原子序数的增大而降低 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性 |
19.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
6.科学家发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子.下列有关这两种粒子的说法不正确的是( )
| A. | “零号元素”在元素周期表中与氢元素占同一位置 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “四中子”不显电性 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
16.下列各组物质中,相互间一定互为同系物的是( )
| A. | 邻二甲苯和对二甲苯 | B. | C4H8O2和C3H6O2 | ||
| C. | C4H10和C20H42 | D. | C6H5-OH和C6H5-CH2-OH |
3.下列溶液中加入足量Na2O2后,仍能大量共存的一组离子是( )
| A. | K+、AlO2-、Cl-、SO42- | B. | Fe2+、HCO3-、K2、SO42- | ||
| C. | Na+、Cl-、AlO2-、NO3- | D. | NH4+、NO3-、I-、CO32- |
20.肼(N2H4)是一种高能燃料,在生产和研究中用途广泛.化学小组同学在实验室中用过量NH3和NaC1O溶液反应制取N2H4(液)并探究其性质.回答下列问题:
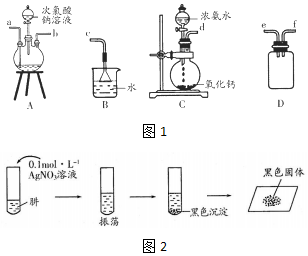
(1)肼的制备
①用图1装置制取肼,其连接顺序为defabc(按气流方向,用小写字母表示).
②装置A中发生反应的化学方程式为NaClO+2NH3=N2H4+NaCl+H2O,装置D的作用是防止倒吸或安全瓶.
(2)探究:N2H4和AgNO3溶液的反应将制得的肼分离提纯后,进行如下实验如图2:
证明黑色沉淀已洗涤干净的操作是取最后一次洗涤液少许于试管中,滴加NaCl溶液,无白色沉淀生成说明沉淀已洗涤干净.
【查阅资料】N2H4水溶液的碱性弱于氨水;N2H4有强还原性.AgOH在溶液中不稳定易分解生成Ag2O;Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】
假设1:黑色固体可能是Ag;
假设2:黑色固体可能是Ag2O;
假设3:黑色固体可能是Ag和Ag2O.
【实验验证】该同学基于上述假设,设计如下方案,进行实验,请完成下表中的空白部分.
根据实验现象,假设1成立,则N2H4与AgNO3溶液反应的离子方程式为N2H4+4Ag+=4Ag↓+N2↑+4H+.

(1)肼的制备
①用图1装置制取肼,其连接顺序为defabc(按气流方向,用小写字母表示).
②装置A中发生反应的化学方程式为NaClO+2NH3=N2H4+NaCl+H2O,装置D的作用是防止倒吸或安全瓶.
(2)探究:N2H4和AgNO3溶液的反应将制得的肼分离提纯后,进行如下实验如图2:
证明黑色沉淀已洗涤干净的操作是取最后一次洗涤液少许于试管中,滴加NaCl溶液,无白色沉淀生成说明沉淀已洗涤干净.
【查阅资料】N2H4水溶液的碱性弱于氨水;N2H4有强还原性.AgOH在溶液中不稳定易分解生成Ag2O;Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】
假设1:黑色固体可能是Ag;
假设2:黑色固体可能是Ag2O;
假设3:黑色固体可能是Ag和Ag2O.
【实验验证】该同学基于上述假设,设计如下方案,进行实验,请完成下表中的空白部分.
| 实验编号 | 操作 | 现象 | 实验结论 |
| 1 | 取少量黑色固体于试管,加入足量氨水,振荡 | 黑色固体不溶解 | 假设1成立 |
| 2 | 操作同实验1 | 黑色固体完全溶解 | 假设2成立 |
| 3 | ①取少量黑色固体于试管中,加入适量氨水,振荡,静置,取上层清液于洁净试管中,加入几滴乙醛,水浴加热②取少量黑色固体于试管中,加入足量稀硝酸,振荡 | ①试管内壁有银镜生成 ②固态完全溶解,并有气体产生 | 假设3成立 |
1. 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS═Na2Sx,电池结构如图所示.下列说法不正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS═Na2Sx,电池结构如图所示.下列说法不正确的是( )
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS═Na2Sx,电池结构如图所示.下列说法不正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS═Na2Sx,电池结构如图所示.下列说法不正确的是( )| A. | 放电时,Na作负极,反应式为Na-e-=Na+ | |
| B. | 钠硫电池在常温下也能正常工作 | |
| C. | 放电时Na+向正极移动 | |
| D. | 当外电路通过0.25mol电子时消耗16g硫,则x=4 |