题目内容
10.下列各项比较中前者高于(或大于或强于)后者的是( )| A. | 金属Mg和金属Cu的空间利用率 | |
| B. | BF3和CH4中心原子的价层电子对数 | |
| C. | 邻羟基苯甲醛(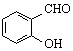 )和对羟基苯甲醛( )和对羟基苯甲醛(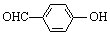 )的沸点 )的沸点 | |
| D. | C-O和Si-O的键能 |
分析 A.金属Mg属于六方最密堆积,金属Cu属于面心立方最密堆积;
B.BF3中心原子的价层电子对数是3、CH4中心原子的价层电子对数4;
C.分子内形成氢键,使熔沸点降低,分子间氢键,使熔沸点升高;
D.原子半径越小,共价键键能越大;
解答 解:A.金属Mg属于六方最密堆积,金属Cu属于面心立方最密堆积,二者的空间利用率相同均为74%,故A错误;
B.BF3中心原子的价层电子对数是3、CH4中心原子的价层电子对数4,所以前者小于后者,故B错误;
C.邻羟基苯甲醛的两个基团靠的很近,能形成分子内氢键,使熔沸点降低;而对羟基苯甲醛能够形成分子间氢键,使熔沸点升高,所以邻羟基苯甲醛比对羟基苯甲醛熔、沸点低,故C错误;
D.原子半径越小,共价键键能越大,原子半径:C<Si,则C-O和Si-O的键能前者高,故D正确;
故选D.
点评 本题考查较为综合,涉及金属晶体的堆积方式、键能比较、价层电子对数的判断、沸点比较等知识,题目难度中等,注意把握比较的方法和角度,注意注意氢键对熔沸点的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.草酸钴用途广泛,可用于指示剂和催化剂的制备.一种利用水钴矿制取草酸钴晶体(CoC2O4?2H2O)工艺流程如图1:
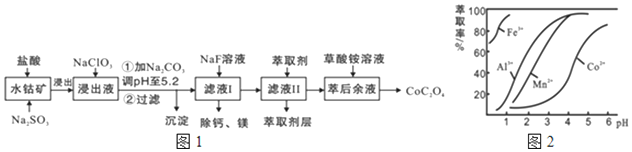
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的 离子方程式为2Co3++SO32-+H2O=2Co2++SO42-+2H+
(2)NaClO3的作用是将Fe2+氧化为Fe3+; 调PH至5.2,沉淀的主要成分为Al(OH)3、Fe(OH)3
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B
A.接近2.0 B.接近3.0 C.接近5.0
(4)除钙、镁是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀,已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+):c(Ca2+)=0.7.
(5)已知含钴废料中含Co2O3质量分数为a%,若取mkg该含钴废料按照上述流程,理论上最多能制得草酸钴晶体的质量为$\frac{1830ma}{83}$或16.6mag.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将Fe2+氧化为Fe3+; 调PH至5.2,沉淀的主要成分为Al(OH)3、Fe(OH)3
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B
A.接近2.0 B.接近3.0 C.接近5.0
(4)除钙、镁是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀,已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+):c(Ca2+)=0.7.
(5)已知含钴废料中含Co2O3质量分数为a%,若取mkg该含钴废料按照上述流程,理论上最多能制得草酸钴晶体的质量为$\frac{1830ma}{83}$或16.6mag.
1.根据元素所在元素周期表的位置,判断下列元素都能作为半导体材料的是( )
| A. | S、K | B. | C、Al | C. | Si、Ge | D. | Ag、Cu |
5.下列有关同分异构体的说法错误的是( )
| A. | 具有相同结构式 | B. | 具有相同分子式 | C. | 具有相同分子量 | D. | 具有相同原子数 |
15.下列有关原电池的叙述中正确的是( )
| A. | 在原电池的外电路中,电子由正极通过导线流向负极 | |
| B. | 在原电池的电解质溶液中,阳离子向负极移动 | |
| C. | 锌锰子电池是一种常用的一次性电池 | |
| D. | 氢氧燃料电池中氢气在负极发生氧化反应 |
2.下列说法正确的是( )
| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | 碱金属元素单质都能保存于煤油中 | |
| C. | 卤族元素单质的熔、沸点随原子序数的增大而升高而碱金属元素单质的熔、沸点随原子序数的增大而降低 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性 |
19.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
20.肼(N2H4)是一种高能燃料,在生产和研究中用途广泛.化学小组同学在实验室中用过量NH3和NaC1O溶液反应制取N2H4(液)并探究其性质.回答下列问题:

(1)肼的制备
①用图1装置制取肼,其连接顺序为defabc(按气流方向,用小写字母表示).
②装置A中发生反应的化学方程式为NaClO+2NH3=N2H4+NaCl+H2O,装置D的作用是防止倒吸或安全瓶.
(2)探究:N2H4和AgNO3溶液的反应将制得的肼分离提纯后,进行如下实验如图2:
证明黑色沉淀已洗涤干净的操作是取最后一次洗涤液少许于试管中,滴加NaCl溶液,无白色沉淀生成说明沉淀已洗涤干净.
【查阅资料】N2H4水溶液的碱性弱于氨水;N2H4有强还原性.AgOH在溶液中不稳定易分解生成Ag2O;Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】
假设1:黑色固体可能是Ag;
假设2:黑色固体可能是Ag2O;
假设3:黑色固体可能是Ag和Ag2O.
【实验验证】该同学基于上述假设,设计如下方案,进行实验,请完成下表中的空白部分.
根据实验现象,假设1成立,则N2H4与AgNO3溶液反应的离子方程式为N2H4+4Ag+=4Ag↓+N2↑+4H+.

(1)肼的制备
①用图1装置制取肼,其连接顺序为defabc(按气流方向,用小写字母表示).
②装置A中发生反应的化学方程式为NaClO+2NH3=N2H4+NaCl+H2O,装置D的作用是防止倒吸或安全瓶.
(2)探究:N2H4和AgNO3溶液的反应将制得的肼分离提纯后,进行如下实验如图2:
证明黑色沉淀已洗涤干净的操作是取最后一次洗涤液少许于试管中,滴加NaCl溶液,无白色沉淀生成说明沉淀已洗涤干净.
【查阅资料】N2H4水溶液的碱性弱于氨水;N2H4有强还原性.AgOH在溶液中不稳定易分解生成Ag2O;Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】
假设1:黑色固体可能是Ag;
假设2:黑色固体可能是Ag2O;
假设3:黑色固体可能是Ag和Ag2O.
【实验验证】该同学基于上述假设,设计如下方案,进行实验,请完成下表中的空白部分.
| 实验编号 | 操作 | 现象 | 实验结论 |
| 1 | 取少量黑色固体于试管,加入足量氨水,振荡 | 黑色固体不溶解 | 假设1成立 |
| 2 | 操作同实验1 | 黑色固体完全溶解 | 假设2成立 |
| 3 | ①取少量黑色固体于试管中,加入适量氨水,振荡,静置,取上层清液于洁净试管中,加入几滴乙醛,水浴加热②取少量黑色固体于试管中,加入足量稀硝酸,振荡 | ①试管内壁有银镜生成 ②固态完全溶解,并有气体产生 | 假设3成立 |