题目内容
粗食盐的杂质主要是MgCl2.为了除去杂质,工业上常把粗盐粉碎后用饱和食盐水浸洗,再过滤出食盐.对此,下面的评论正确的是( )
| A、浸洗前后,被浸洗的食盐中MgCl2的含量基本不变 |
| B、用来浸洗的饱和食盐水在浸洗前后没有变化 |
| C、浸洗用过的饱和食盐水可以无限次地使用下去 |
| D、粉碎颗粒的大小影响浸洗后盐中MgCl2的含量 |
考点:物质的分离、提纯的基本方法选择与应用,溶解度、饱和溶液的概念,物质的分离、提纯和除杂
专题:化学实验基本操作
分析:由信息可知,把粗盐粉碎后用饱和食盐水浸洗,再过滤出食盐,可知氯化镁能溶解,而氯化钠不能溶解,然后过滤可分离,以此来解答.
解答:
解:A.用饱和食盐水浸洗,氯化镁溶解,则浸洗前后氯化镁含量不同,故A错误;
B.用来浸洗的饱和食盐水在浸洗后总质量变大,因溶解了氯化镁,故B错误;
C.浸洗用过的饱和食盐水,当氯化镁达到饱和溶液时,不能再使用,故C错误;
D.块状不同溶解较慢,而粉末固体溶解快,则粉碎颗粒的大小影响浸洗后盐中MgCl2的含量,故D正确;
故选D.
B.用来浸洗的饱和食盐水在浸洗后总质量变大,因溶解了氯化镁,故B错误;
C.浸洗用过的饱和食盐水,当氯化镁达到饱和溶液时,不能再使用,故C错误;
D.块状不同溶解较慢,而粉末固体溶解快,则粉碎颗粒的大小影响浸洗后盐中MgCl2的含量,故D正确;
故选D.
点评:本题考查物质分离、提纯的方法和选择,为高频考点,把握饱和NaCl溶液中溶解能力为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
下列实验方案设计合理且能达到相应实验预期目的是( )
A、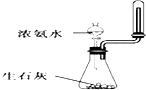 制取少量氨气 |
B、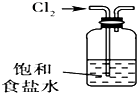 除去氯气中的HCl杂质 |
C、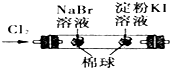 证明氧化性Cl2>Br2>I2 |
D、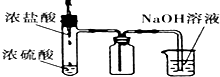 制取HCl且除去多余的气体 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的( )
| A、CaCO3(s) |
| B、Na2SO4溶液 |
| C、KNO3溶液 |
| D、CuSO4(s) |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入6mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、45 mL |
| C、30 mL |
| D、50 mL |
常温下,下列各组离子在制定溶液中一定能大量共存的是( )
| A、在水溶液中:H+、I-、ClO-、SiO32- |
| B、酸性溶液中:H+、NH4+、Al3+、SO42- |
| C、碱性溶液中:Na+、Al3+、AlO2-、I- |
| D、饱和氯水中:OH-、CO32-、Na+、SO32- |
下列物质属于电解质的是( )
| A、铜 |
| B、AgNO3 |
| C、蔗糖 |
| D、硫酸 |
 某学习小组用0.10mol?L-1的标准NaOH溶液滴定20.00mL某未知浓度的酸HA,指示剂变色时认为酸碱恰好反应,此时测得溶液的pH为8.7.该小组绘制的滴定曲线如图:
某学习小组用0.10mol?L-1的标准NaOH溶液滴定20.00mL某未知浓度的酸HA,指示剂变色时认为酸碱恰好反应,此时测得溶液的pH为8.7.该小组绘制的滴定曲线如图: