题目内容
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的( )
| A、CaCO3(s) |
| B、Na2SO4溶液 |
| C、KNO3溶液 |
| D、CuSO4(s) |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:因Fe过量,则减小氢离子的浓度,不改变氢离子的物质的量,可满足减缓反应速率但又不影响生成H2的总量,以此来解答.
解答:
解:A.因盐酸与NCaCO3固体反应,会导致生成氢气的量减少,故A错误;
B.加入Na2SO4溶液,溶液体积增大,浓度减小,反应速率减小,但生成氢气的总量不变,故B正确;
C.加入KNO3溶液,生成NO气体而不生成氢气,故C错误;
D.加入硫酸铜,置换出铜,形成原电池反应,加快反应速率,故D错误.
故选B.
B.加入Na2SO4溶液,溶液体积增大,浓度减小,反应速率减小,但生成氢气的总量不变,故B正确;
C.加入KNO3溶液,生成NO气体而不生成氢气,故C错误;
D.加入硫酸铜,置换出铜,形成原电池反应,加快反应速率,故D错误.
故选B.
点评:本题考查影响化学反应速率的因素,注意氢离子的浓度变小而总物质的量不变是解答本题的关键,并熟悉物质之间的反应来解答,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列各组中的离子能在溶液中大量共存,向溶液中加入NaOH溶液时产生沉淀,且加入盐酸时放出气体的离子组是( )
| A、OH-、Ba2+、NO3-、K+ |
| B、Fe2+、Ca2+、Br-、NO3- |
| C、Na+、SO42-、Cu2+、Cl- |
| D、CO32-、Cl-、Na+、Ba2+ |
由乙炔(C2H2)、苯和乙醛组成的混和物中,测得含碳元素的质量百分含量为72%,则混和物中氧元素的质量百分含量为( )
| A、19.56% | B、20% |
| C、22% | D、25% |
25℃时,在BaSO4的饱和溶液中存在:BaSO4(s)?Ba2+(aq)+SO42-(aq),Ksp=1.1025×10-10,在该温度下有关BaSO4的溶度积和溶解平衡的叙述正确的是( )
| A、向c(SO42-)=1.05×10-5mol/L的BaSO4溶液中加入BaSO4固体,c(SO42-)增大 |
| B、向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大 |
| C、向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO42-) |
| D、向该饱和溶液中加入BaCl2固体,则该溶液中c(SO42-)减小 |
粗食盐的杂质主要是MgCl2.为了除去杂质,工业上常把粗盐粉碎后用饱和食盐水浸洗,再过滤出食盐.对此,下面的评论正确的是( )
| A、浸洗前后,被浸洗的食盐中MgCl2的含量基本不变 |
| B、用来浸洗的饱和食盐水在浸洗前后没有变化 |
| C、浸洗用过的饱和食盐水可以无限次地使用下去 |
| D、粉碎颗粒的大小影响浸洗后盐中MgCl2的含量 |
在2A(g)+3B(g)=C(g)+4D(g)的反应中,下列表示该反应的化学反应速度最快的是( )
| A、v (A)=0.5 mol/(L?s) |
| B、v (B)=0.9 mol/(L?s) |
| C、v (C)=0.8 mol/(L?s) |
| D、v (D)=1.0 mol/(L?s) |
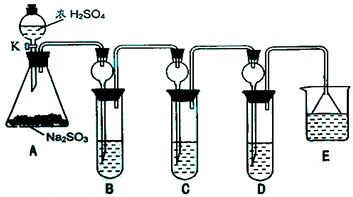 某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.
某研究小组欲探究SO2的化学性质,设计了如右图所示实验方案.