题目内容
11.某待测溶液中只可能含有Ag+、Fe2+、Na+、Ba2+、${CO}_{3}^{2-}$、${NO}_{3}^{-}$、${SO}_{4}^{2-}$中的几种离子,依次进行下列实验:①取少量待测液,加入足量的NaCl溶液,没有明显现象
②继续加入足量的Na2SO4溶液,有白色沉淀生成
③过滤,取少量滤液,加入足量的NaOH溶液,有白色絮状沉淀生成,迅速变为灰绿色,最后变为红褐色
根据实验现象回答:
(1)待测液中一定含有Fe2+、Ba2+、NO3-离子,一定没有Ag+、CO32-、SO42-离子.
(2)写出步骤②中发生反应的离子方程式SO42-+Ba2+=BaSO4↓.
(3)写出步骤③中沉淀由白色变为红褐色的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 由①取少量待测液,加入足量的NaCl溶液,无明显现象,溶液中一定不存在Ag+;
②继续加入足量的Na2SO4溶液,有白色沉淀生成,溶液中一定存在Ba2+,则一定不存在SO42-和CO32-,根据溶液电中性可知,溶液中一定存在唯一的阴离子NO3-;
③过滤,取少量滤液,加入足量NaOH溶液,有白色絮状沉淀生成,迅速变成灰绿色,最终变成红褐色,该现象说明溶液中一定存在Fe2+,以此来解答.
解答 解:(1)由以上分析可知,溶液中一定存在的离子为Fe2+、Ba2+、NO3-,一定不存在的离子为Ag+、CO32-、SO42-,
故答案为:Fe2+、Ba2+、NO3-;Ag+、CO32-、SO42-;
(2)步骤②中发生反应的反应为硫酸根离子与钡离子反应生成硫酸钡,反应的离子方程式为SO42-+Ba2+=BaSO4↓;
故答案为:SO42-+Ba2+=BaSO4↓;
(3)步骤③中沉淀由白色变为红褐色,是氢氧化亚铁与氧气反应生成氢氧化铁的反应,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查常见离子的推断,为高频考点,把握离子之间的反应、现象为解答的关键,侧重分析与推断能力的考查,注意电中性的应用,题目难度不大.

练习册系列答案
相关题目
1.某烃中碳和氢的质量比为24:5,该烃在标准状况下的密度是2.59g•L-1,该烃的分子式为( )
| A. | C2H6 | B. | C4H10 | C. | C5H8 | D. | C4H8 |
2.短周期元素W、X、Y和Z的原子序数依次增大.W原子是半径最小的原子,X原子的最外层电子数是内层电子数的3倍,元素Y与W同主族,Z原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
| A. | 四种元素在自然界中都有游离态 | |
| B. | X分别与W、Y、Z都可组成具有漂白性的物质,且它们的漂白原理相同 | |
| C. | 元素W、Y的氯化物中,各原子(或离子)均满足8电子的稳定结构 | |
| D. | 元素W可与元素X形成一种既含极性键又含非极性键的共价化合物 |
19.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 蒸发结晶时应将溶液完全蒸干 | |
| D. | 洗涤沉淀的方法是向漏斗中加水,使水没过沉淀,等水流完后再重复操作几次 |
6.常吃菠菜可以补铁,这里的“铁”是指( )
| A. | 分子 | B. | 元素 | C. | 原子 | D. | 单质 |
16.几种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性.下列说法不正确的是( )
| M | N | ||
| X | Y |
| A. | 元素的第一电离能X<Y | |
| B. | X位于第三周期 IIA,其单质可采用电解熔融其氯代物制备 | |
| C. | 元素最高价氧化物的水化物中,酸性最强的是HNO3 | |
| D. | 气体分子(MN)2的电子式为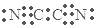 |
20.下列有关几种试纸使用的描述中,正确的是( )
| A. | 用湿润的蓝色石蕊试纸检验某种气体是否是NH3 | |
| B. | 某种有色溶液可使淀粉-KI试纸变蓝色,则该溶液中一定含有Fe3+ | |
| C. | 用玻璃棒蘸取溶液点在用蒸馏水湿润过的pH试纸上可测量该溶液的pH | |
| D. | 将湿润的蓝色石蕊试纸片粘在玻璃棒上置于氯气中,试纸先变红后褪色 |
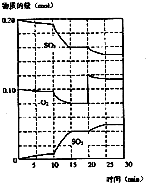 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).