题目内容
2. (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).(2)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2 (g)?2SO3(g) (△H<0)
①写出该反应的化学平衡常数表达式 K=$\frac{[S{O}_{3}]^{2}}{[S{O}_{2}]^{2}•[{O}_{2}]}$
②降低温度,该反应K值增大,二氧化硫转化率增大,化学反应速度减小(以上均填增大、减小或不变)
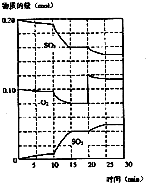
③600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是15-20min;25-30min.
④据图判断,反应进行至20min时,曲线发生变化的原因是增加了O2的浓度(用文字表达)
⑤10min到15min的曲线变化的原因可能是ab(填写编号).
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.
分析 (1)依据平衡常数是表示平衡进行程度大小的量;化学反应吸热或放热反应,温度升高平衡向吸热反应方向进行;
(2)①依据化学平衡常数的概念分析计算,平衡常数等于生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
②依据反应是放热反应,升温平衡向吸热反应方向进行,降温平衡向放热反应方向进行;K增大,二氧化碳转化率增大;反应速率减小;
③依据图象分析浓度不变说明达到平衡;
④反应进行至20min时,曲线发生变化是氧气增大浓度平衡正向进行;
⑤10min到15min,曲线斜率增大,反应速率加快,以此来解答.
解答 解:(1)化学平衡常数K表示可逆反应的进行程度,依据平衡常数含义可知,K值越大,可逆反应的进行程度越大;温度升高,平衡向吸热反应方向进行,反应可能是吸热反应,也可能是放热反应,所以温度升高,平衡常数可能增大也可能减小,
故答案为:可逆反应的进行程度越大;可能增大也可能减小;
(2)①依据反应可知,2SO2(g)+O2 (g)?2SO3(g)反应的平衡常数概念计算得到:K=$\frac{[S{O}_{3}]^{2}}{[S{O}_{2}]^{2}•[{O}_{2}]}$,故答案为:$\frac{[S{O}_{3}]^{2}}{[S{O}_{2}]^{2}•[{O}_{2}]}$;
②反应是放热反应,所以降温,平衡正向进行,K值增大;二氧化硫转化率增大,降温化学反应的速率减小,故答案为:增大;增大;减小;
③反应达到平衡物质的浓度不变,结合图象分析可知:15-20min 25-30min 达到平衡,故答案为:15-20min;25-30min;
④据图判断,反应进行至20min时,曲线发生变化的原因是增加了O2的浓度,平衡正向进行,故答案为:增加了O2的浓度;
⑤10min到15min,曲线斜率增大,反应速率加快,加催化剂、缩小容器体积均加快反应速率,降低温度反应速率减小,若增加SO3的物质的量平衡逆向移动,反应物浓度增大与图象不符,故答案为:ab.
点评 本题考查化学平衡的计算,为高频考点,把握K的表达式及影响因素、平衡移动为解答的关键,侧重分析与应用能力的考查,注意图象与平衡移动原理的结合,题目难度不大.

①MnO2(s)+C(s)═MnO(s)+CO(g)△H1=+24.4kJ•mol-1
②MnO2(s)+CO(s)═MnO(s)+CO2(g)△H2=-148.1kJ•mol-1
③2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H3
则下列判断正确的是( )
| A. | △H1<△H3 | B. | △H3=△Hl+△H2 | ||
| C. | 反应①的活化能为24.4 kJ•mol-1 | D. | 反应③一定不能自发进行 |
| A. | 加水稀释时.在$\frac{c(O{H}^{-})}{C({H}^{+})}$的值增大的溶液中可大量存在:MnO4-、CO32-、K+、NH4+ | |
| B. | 100℃时,将pH=2的硫酸溶液与pH=12的氢氧化钠溶液等体积混合,溶液显中性 | |
| C. | 25℃时,NaB溶液的pH=9,则c(Na+ )-c(B-)=9.9×10-6mol•L-1 | |
| D. | 将0.2mol•L-1 的一元弱酸HA溶液和0.1mol•L-1 的NaOH溶液等体积混合:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| 操作 | 现象 |
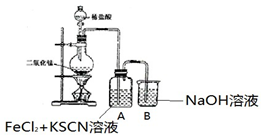 | I.A 中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)实验室常用排饱和食盐水的方法来收集 Cl2,试用化学平衡原理加以解释因为饱和食盐水中 C(Cl-)较大,促使平衡 Cl2+H2O?H++Cl-+HClO逆向移动,减少Cl2 的溶解.
以下甲学生对 Cl2 与 FeCl2 和 KSCN 混合溶液的反应进行实验探究.
(3)A 中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(4)为了探究现象 II 的原因,甲同学进行如下实验.
①取 A 中黄色溶液于试管中,加入 NaOH 溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取 A 中黄色溶液于试管中,加入过量的 KSCN 溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是 SCN-与 Cl2发生了反应.
(5)甲同学猜想 SCN-可能被 Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
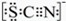
①甲同学认为 SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取 A 中黄色溶液于试管中,加入用盐酸酸化的 BaCl2溶液,产生白色沉淀,由此证明被氧化的元素是硫元素(填名称).
③通过实验证明了 SCN-中氮元素转化为 NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在SCN-中氮元素被氧化成NO3-.中被氧化的元2
④若 SCN-与 Cl反应生成 CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+16Cl-+18H+,.
| 起始浓度 | 甲 | 乙 | 丙 |
| C(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| C(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 平衡时,丙中SO2的转化率大于50% | |
| B. | 当反应平衡时,乙中c(NO2)是甲中的2倍 | |
| C. | 温度升至90℃,上述反应平衡常数为$\frac{25}{26}$,则Z正反应为吸热反应 | |
| D. | 其他条件不变,若起始时向容器乙中充入0.10mol•L-lNO2和0.20mol•L-lSO2,达到平衡时c(NO)与原平衡相同 |
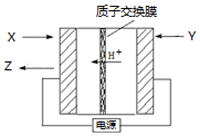 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | Y参与的电极反应为H2+2e-=2H+ | |
| B. | 反应过程中左边区域溶液pH逐渐升高 | |
| C. | 图中所示物质中,X为H2,Y为N2 | |
| D. | 当有3g H+通过质子交换膜时,Z的体积为22.4L |