题目内容
 (1)某矿石由几种常见氧化物组成,组成这些氧化物的元素在地壳中的含量都很丰富.向该矿石混合粉末中加入过量的氢氧化钠溶液,过滤得可用作红色涂料的红棕色固体和无色溶液,然后向所得溶液中滴入盐酸,所得沉淀的质量与所加盐酸的体积的关系如图所示:
(1)某矿石由几种常见氧化物组成,组成这些氧化物的元素在地壳中的含量都很丰富.向该矿石混合粉末中加入过量的氢氧化钠溶液,过滤得可用作红色涂料的红棕色固体和无色溶液,然后向所得溶液中滴入盐酸,所得沉淀的质量与所加盐酸的体积的关系如图所示:①该矿石中含有的氧化物的化学式分别为:
②向滤液中滴加盐酸过程中发生反应的离子方程式为:
(2)100mL某溶液中含有的离子及其浓度如下:(其中XO32-为中学常见的酸根离子)
| 离子 | Na+ | K+ | XO32- | SO42- |
| 浓度(mol?L-1) | 0.3 | 0.2 | 0.05 | 0.15 |
A.Mg2+ B.Cl- C.ClO- D.NH4+
②确定XO32-是哪种酸根的方法是
考点:探究物质的组成或测量物质的含量,离子方程式的有关计算
专题:
分析:(1)红棕色固体是氧化铁,氧化铝能和强碱氢氧化钠反应生成偏铝酸钠,二氧化硅能和强碱氢氧化钠反应生成硅酸钠,硅酸钠可以和盐酸反应生成硅酸白色沉淀;
结合分析过程,向溶液中加入盐酸,先是和过量的氢氧化钠发生中和反应,然后出现沉淀,直到最大量,是偏铝酸钠和盐酸反应生成氯化钠和氢氧化铝的过程,但是随后沉淀有一部分未溶解,所以加盐酸产生的不只是氢氧化铝,还有一种沉淀生成,据答案可知,只能是二氧化硅和氢氧化钠反应生成的硅酸钠与盐酸反应生成的硅酸沉淀;
(2)①结合溶液的电荷守恒解答该题;
②标注元素化合价为+4价,可能为碳酸根离子或亚硫酸根离子分析.
结合分析过程,向溶液中加入盐酸,先是和过量的氢氧化钠发生中和反应,然后出现沉淀,直到最大量,是偏铝酸钠和盐酸反应生成氯化钠和氢氧化铝的过程,但是随后沉淀有一部分未溶解,所以加盐酸产生的不只是氢氧化铝,还有一种沉淀生成,据答案可知,只能是二氧化硅和氢氧化钠反应生成的硅酸钠与盐酸反应生成的硅酸沉淀;
(2)①结合溶液的电荷守恒解答该题;
②标注元素化合价为+4价,可能为碳酸根离子或亚硫酸根离子分析.
解答:
解:(1)根据题意向该粉末试样中加入过量的氢氧化钠溶液,充分溶解后过滤得红棕色固体和无色溶液,则一定含有氧化铁固体,故C、D错误,
根据图象可知,向溶液中加入盐酸,先是和过量的氢氧化钠发生中和反应,然后出现沉淀,直到最大量,是偏铝酸钠和盐酸反应生成氯化钠和氢氧化铝的过程,但是随后沉淀有一部分未溶解,所以加盐酸产生的不只是氢氧化铝,还有一种沉淀生成,据答案可知,只能是二氧化硅和氢氧化钠反应生成的硅酸钠与盐酸反应生成的硅酸沉淀,既粉末试样含有氧化铝和二氧化硅,即为Fe2O3、SiO2、Al2O3的混合物;
①上述分析可知该矿石中含有的氧化物的化学式分别为:Fe2O3;Al2O3;SiO2;
故答案为:Fe2O3;Al2O3;SiO2;
②向溶液中加入盐酸,先是和过量的氢氧化钠发生中和反应,然后出现沉淀,直到最大量,是偏铝酸钠和盐酸反应生成氯化钠和氢氧化铝的过程,但是随后沉淀有一部分未溶解,所以加盐酸产生的不只是氢氧化铝,还有一种沉淀生成,据答案可知,只能是二氧化硅和氢氧化钠反应生成的硅酸钠与盐酸反应生成的硅酸沉淀,向滤液中滴加盐酸过程中发生反应的离子方程式为:H++OH-=H2O、AlO2-+H++H2O=Al(OH)3↓、SiO32-+2H+=H2SiO3↓、Al(OH)3+3H+=Al3++3H2O;
故答案为:H++OH-=H2O、AlO2-+H++H2O=Al(OH)3↓、SiO32-+2H+=H2SiO3↓、Al(OH)3+3H+=Al3++3H2O;
(2)①100mL某溶液中含有的离子及其浓度分析可知,电解质溶液中存在电荷守恒,阳离子所带电荷总数等于阴离子所带电荷总数,图表中阳离子和阴离子所带电荷总数c(Na+)+c(K+)=0.3mol/L+0.2mol/L=0.5mol/L,阴离子电荷总数2c(XO32-)+2c(SO42-)=0.05mol/L×2+0.15mol/L×2=0.4mol/L,所以溶液中还含有的离子一定是阴离子,选项中BC为阴离子,其中ClO-可能存在,若为SO32-则不能存在ClO-,一定存在的是Cl-,浓度为0.1mol/L,物质的量=0.1mol/L×0.1L=0.01mol;
故答案为:B;0.01mol;
②XO32-酸根中X元素化合价为+4价,可能是碳酸根离子或亚硫酸根离子,检验方法为:取该溶液于试管中,滴加稀盐酸,产生的气体能使品红溶液褪色,则为SO32-,不能使品红溶液褪色为CO32-;若产生白色沉淀,则为SiO32-;
故答案为:取该溶液于试管中,滴加稀盐酸,产生的气体能使品红溶液褪色,则为SO32-,不能使品红溶液褪色为CO32-;若产生白色沉淀,则为SiO32-.
根据图象可知,向溶液中加入盐酸,先是和过量的氢氧化钠发生中和反应,然后出现沉淀,直到最大量,是偏铝酸钠和盐酸反应生成氯化钠和氢氧化铝的过程,但是随后沉淀有一部分未溶解,所以加盐酸产生的不只是氢氧化铝,还有一种沉淀生成,据答案可知,只能是二氧化硅和氢氧化钠反应生成的硅酸钠与盐酸反应生成的硅酸沉淀,既粉末试样含有氧化铝和二氧化硅,即为Fe2O3、SiO2、Al2O3的混合物;
①上述分析可知该矿石中含有的氧化物的化学式分别为:Fe2O3;Al2O3;SiO2;
故答案为:Fe2O3;Al2O3;SiO2;
②向溶液中加入盐酸,先是和过量的氢氧化钠发生中和反应,然后出现沉淀,直到最大量,是偏铝酸钠和盐酸反应生成氯化钠和氢氧化铝的过程,但是随后沉淀有一部分未溶解,所以加盐酸产生的不只是氢氧化铝,还有一种沉淀生成,据答案可知,只能是二氧化硅和氢氧化钠反应生成的硅酸钠与盐酸反应生成的硅酸沉淀,向滤液中滴加盐酸过程中发生反应的离子方程式为:H++OH-=H2O、AlO2-+H++H2O=Al(OH)3↓、SiO32-+2H+=H2SiO3↓、Al(OH)3+3H+=Al3++3H2O;
故答案为:H++OH-=H2O、AlO2-+H++H2O=Al(OH)3↓、SiO32-+2H+=H2SiO3↓、Al(OH)3+3H+=Al3++3H2O;
(2)①100mL某溶液中含有的离子及其浓度分析可知,电解质溶液中存在电荷守恒,阳离子所带电荷总数等于阴离子所带电荷总数,图表中阳离子和阴离子所带电荷总数c(Na+)+c(K+)=0.3mol/L+0.2mol/L=0.5mol/L,阴离子电荷总数2c(XO32-)+2c(SO42-)=0.05mol/L×2+0.15mol/L×2=0.4mol/L,所以溶液中还含有的离子一定是阴离子,选项中BC为阴离子,其中ClO-可能存在,若为SO32-则不能存在ClO-,一定存在的是Cl-,浓度为0.1mol/L,物质的量=0.1mol/L×0.1L=0.01mol;
故答案为:B;0.01mol;
②XO32-酸根中X元素化合价为+4价,可能是碳酸根离子或亚硫酸根离子,检验方法为:取该溶液于试管中,滴加稀盐酸,产生的气体能使品红溶液褪色,则为SO32-,不能使品红溶液褪色为CO32-;若产生白色沉淀,则为SiO32-;
故答案为:取该溶液于试管中,滴加稀盐酸,产生的气体能使品红溶液褪色,则为SO32-,不能使品红溶液褪色为CO32-;若产生白色沉淀,则为SiO32-.
点评:本题考查常见的氧化物,图象分析判断,离子性质和离子检验方法,注意物质的性质的灵活应用,氧化铝能和强碱反应生成的偏铝酸钠能溶于盐酸,产物随盐酸量的多少而不同,硅酸不溶于水,电解质溶液中存在电荷守恒,题目难度中等.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1 mol SiO2晶体中有2NA个Si-O键 |
| B、0.5 mol I-被氧化时失去的电子数为0.5NA |
| C、在0℃,压强为1.01×105 Pa时,11.2 L SO3所含原子数目为2NA |
| D、常温常压下,48 g O3含有氧原子数为3NA |
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L,下面四个选项中能达到此目的是( )
| A、Ca2+、K+、OH-、Cl-、NO3- |
| B、Fe2+、H+、Br+、NO3-、Cl- |
| C、Na+、NH4+、SO42-、NO3-、Cl- |
| D、Al3+、H+、Cl-、SO42-、NO3- |
下列各组离子一定能在常温指定环境中大量共存的是( )
| A、在c(H+)=10-10mol?L-1的溶液中:Al3+、NH4+、Cl-、NO3- |
| B、pH值为1的溶液:Fe2+、Na+、SO42-、NO3- |
| C、水电离出来的c(H+)=10-12 mol?L-1的溶液:K+、HCO3-、Cl-、ClO- |
| D、pH值为13的溶液:K+、CO32-、Na+、S2- |
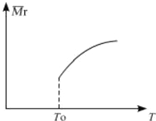 用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)
用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)