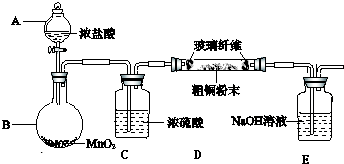
题目内容
19.汽车尾气净化反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),请回答下列问题:(1)对于气相反应,用某组分B平衡时的分压p(B)代替物质的量浓度c(B)也可表示平衡常数,记作KP,则该反应的平衡常数KP表达式为$\frac{p({N}_{2})•{p}^{2}(C{O}_{2})}{{p}^{2}(NO)•{p}^{2}(CO)}$.若恒温恒压条件下反应达到平衡后,将体系中N2移走,则平衡常数KP不变(填“变大”、“变小”或“不变”)
(2)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
则2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-746.5kJ•mol-1
(3)在一定温度下,向体积为 V L的密闭容器中充入一定量的NO和CO.在t1时刻达到平衡状态,此时n(NO)=2a mol,n(CO)=a mol,n(N2)=b mol.
①若保持体积不变,再向容器中充入n(NO)=a mol,n(CO2)=b mol,则此时v正=v逆(填“>”、“=”或“<”);
②在t2时刻,将容器迅速压缩到原容积的$\frac{1}{2}$,在其它条件不变的情况下,t3时刻达到新的平衡状态.请在图1中补充画出t2-t3-t4时段N2物质的量的变化曲线.
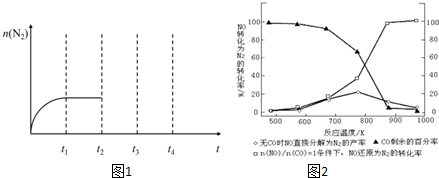
(4)某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图2所示.若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为NO分解反应是放热反应,升高温度不利于反应进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870K左右.
分析 (1)由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比;压强不变,Kp不变;
(2)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
根据盖斯定律:②×2-①-③得2NO(g)+2CO(g)?N2(g)+2CO2(g),再计算△H;
(3))①一定温度下,向V L的密闭容器中充入一定量NO和CO.在t1时刻达到平衡状态,此时n(NO)=2amol,n(CO)=amol,n(N2)=bmol,则:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol):2a+2b a+2b 0 0
变化量(mol):2b 2b b 2b
平衡量(mol):2a a b 2b
计算该反应的平衡常数K,再计算再向容器中充入n(NO)=a mol,n(CO2)=b mol的Qc,比较两者的大小判断反应方向;
②在其它条件不变的情况下在t2时刻,将容器迅速压缩到原容积的一半,瞬间氮气物质的量不变,压强增大,平衡正向移动,氮气物质的量增大到平衡时保持不变;
(4)分析图象的曲线变化特征判断,升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,该反应放热.
解答 解:(1)由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比,故2NO(g)+2CO(g)?N2(g)+2CO2(g)用平衡分压表示的平衡常数Kp=$\frac{p({N}_{2})•{p}^{2}(C{O}_{2})}{{p}^{2}(NO)•{p}^{2}(CO)}$;压强不变,Kp不变;
故答案为:$\frac{p({N}_{2})•{p}^{2}(C{O}_{2})}{{p}^{2}(NO)•{p}^{2}(CO)}$;不变;
(2)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
根据盖斯定律:②×2-①-③得2NO(g)+2CO(g)?N2(g)+2CO2(g),△H=-746.5 kJ•mol-1;
故答案为:-746.5 kJ•mol-1;
(3)①一定温度下,向V L的密闭容器中充入一定量NO和CO.在t1时刻达到平衡状态,此时n(NO)=2amol,n(CO)=amol,n(N2)=bmol,则:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol):2a+2b a+2b 0 0
变化量(mol):2b 2b b 2b
平衡量(mol):2a a b 2b
计算该反应的平衡常数K=$\frac{(2b÷V)^{2}×(b÷V)}{(2a÷V)^{2}×(a÷V)^{2}}$=$\frac{{b}^{3}V}{{a}^{4}}$;再计算再向容器中充入n(NO)=a mol,n(CO2)=b mol的Qc=$\frac{(3b÷V)^{2}×(b÷V)}{(3a÷V)^{2}×(a÷V)^{2}}$=$\frac{{b}^{3}V}{{a}^{4}}$=K,故v正=v逆;
故答案为:=;
②在其它条件不变的情况下在t2时刻,将容器迅速压缩到原容积的一半,瞬间氮气物质的量不变,压强增大,平衡正向移动,氮气物质的量增大到平衡时保持不变,t2-t3-t4时段N2物质的量的变化曲线为: ;
;
故答案为: ;
;
(4)升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,该反应放热;由图可知,在$\frac{n(NO)}{n(CO)}$=1的条件下,870K时,NO还原为N2的转化率为100%;
故答案为:NO分解反应是放热反应,升高温度不利于反应进行;870K.
点评 本题考查盖斯定律的应用、放热反应与吸热反应、热化学方程式的书写.难度中等.根据图象分析出分解率的变化特点是解题的关键.

| A. | 400mL | B. | 500mL | C. | 450mL | D. | 无法确定 |
| A. | 在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热 | |
| C. | 燃烧热和中和热是反应热的种类之一 | |
| D. | 在稀溶液中,1 mol乙酸和1 mol氢氧化钠完全中和时放出的热量为57.3 kJ |
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.
(3)测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是D.
A.KBr B.KI C.K2S D.K2CrO4.
判断以下3个热化学方程式:①C(s)+2H2(g)=CH4(g)△H1
②C(s)+$\frac{1}{2}$H2(g)=$\frac{1}{2}$C2H2(g)△H2③C(s)+H2(g)=$\frac{1}{2}$C2H4(g)△H3
△H1、△H2、△H3由大到小的顺序是( )
| A. | △H2>△H3>△H1 | B. | △H3>△H2>△H1 | C. | △H3>△H1>△H2 | D. | △H1>△H2>△H3 |
| A. | p2<p1 | B. | p1<p2<2p 1 | C. | p1>2p2 | D. | 2p1=p2 |

 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 
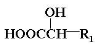 上的羟基可以氧化成羰基,再脱羧变成醛;
上的羟基可以氧化成羰基,再脱羧变成醛; (R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为
(R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为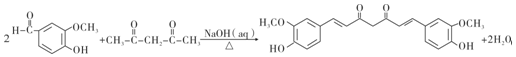
 可用于合成有机高分子色素,根据Claisen缩合反应,设计
可用于合成有机高分子色素,根据Claisen缩合反应,设计 .
. A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: