题目内容
10.下列叙述不正确的是( )| A. | 检验Fe2(SO4)3溶液中是否含有FeSO4的实验操作是:取少量待测液于试管中,滴加1-2滴酸性KMnO4溶液 | |
| B. | 碱金属与卤素所形成的化合物具有熔点较高,能溶于水,水溶液能导电,熔融状态下能导电的性质 | |
| C. | 配制FeCl2溶液的实验操作是:在装有适量固体的大试管中加入适量的蒸馏水,再滴加少量稀盐酸并搅拌,同时加入少量的铁粉 | |
| D. | 向紫色石蕊试液中加入过量的过氧化钠粉末振荡,可观察到溶液中有气泡产生,溶液最终变为无色 |
分析 A.二价铁离子具有还原性,能被酸性高锰酸钾溶液氧化,而铁离子不与酸性高锰酸钾溶液反应;
B.卤素单质与碱金属形成的化合物属于离子化合物,结合离子化合物性质分析;
C.亚铁离子易水解,应该用浓盐酸溶解氯化亚铁;
D.向紫色石蕊试液中加入过量的Na2O2粉末,过氧化钠先与水反应生成氢氧化钠和氧气,成碱性使溶液变为蓝色,后过量的Na2O2粉末又具有强氧化性漂白,据此分析.
解答 解:A.二价铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,而铁离子不与酸性高锰酸钾溶液反应,则可以用酸性高锰酸钾溶液检验二价铁离子,故A正确;
B.碱金属与卤素所形成的化合物为离子化合物,离子化合物具有熔点较高,能溶于水,水溶液能导电,熔融状态下能导电的性质,故B正确;
C.FeCl2为强酸弱碱盐,在水溶液中存在水解平衡:FeCl2+2H2O?Fe(OH)2+2HCl,配制时应把FeCl2固体溶解在适量浓盐酸中,抑制FeCl2水解,防止所配溶液浑浊,故C错误;
D.向紫色石蕊试液中加入过量的Na2O2粉末,过氧化钠先与水反应生成氢氧化钠和氧气,呈碱性使溶液变为蓝色,后过量的Na2O2粉末又具有强氧化性漂白,所以看到的现象为,溶液先变为蓝色后褪色,并有气泡产生,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高考高频点,题目难度中等,涉及离子检验、氯化亚铁溶液配制方法、离子化合物性质、过氧化钠性质等知识,明确实验原理是解本题关键,注意掌握常见离子检验方法,试题培养了学生的化学实验能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
20.“玉兔”号月球车用${\;}_{94}^{238}$Pu作为热源材料.下列关于${\;}_{94}^{238}$Pu的说法正确的是( )
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的最外层电子数 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的中子数 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 |
1.解释下列事实的方程式正确的是( )
| A. | 淀粉碘化钾在空气中变蓝:2I-+O2+4H+═2H2O+I2 | |
| B. | Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:CO32-+Ca2+=CaCO3↓ | |
| D. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2=2CO2+2CaSO4 |
18.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.2mol Cu(OH)2后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解),则电解过程中转移电子的物质的量为( )
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
15.分子式为C9H10O2,能与NaHCO3溶液反应放出CO2气体,且苯环上的一氯代物有两种的有机物有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.下列说法正确的是( )
| A. | ${\;}_{\;}^{16}{O}_{2}$、${\;}_{\;}^{18}{O}_{2}$互为同位素 | B. | H2O、D2O、T2O的化学性质不同 | ||
| C. | 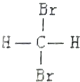 和 和 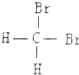 是两种不同结构 是两种不同结构 | D. | 白磷与红磷互为同素异形体 |
19.一种二次电池如图所示,该电池的电解质为强碱溶液,下列说法中正确的是( )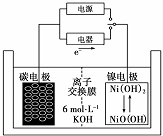

| A. | 充电时阴极发生氧化反应 | |
| B. | 充电时将碳电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e -=2H+ | |
| D. | 放电时镍电极反应为NiO(OH)+H20+e-=Ni( OH)2+OH - |
20.下列有关NaHCO3溶液的说法正确的是( )
| A. | 该溶液中,H+、Al3+、Cl?能大量共存 | |
| B. | 溶液中c(H2CO3)<c(CO32?) | |
| C. | 该溶液中阳离子总数大于阴离子总数 | |
| D. | 常温下,加水稀释,$\frac{c({H}^{+}).c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$变小 |