题目内容
20.下列有关NaHCO3溶液的说法正确的是( )| A. | 该溶液中,H+、Al3+、Cl?能大量共存 | |
| B. | 溶液中c(H2CO3)<c(CO32?) | |
| C. | 该溶液中阳离子总数大于阴离子总数 | |
| D. | 常温下,加水稀释,$\frac{c({H}^{+}).c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$变小 |
分析 A、HCO3-与Al3+发生双水解;
B、HCO3-的水解大于电离;
C、根据电荷守恒来分析;
D、$\frac{c({H}^{+}).c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$为HCO3-的电离平衡常数.
解答 解:A、HCO3-与Al3+发生双水解,故在溶液中不能共存,故A错误;
B、HCO3-的水解大于电离,故水解出的c(H2CO3)大于电离出的c(CO32?),故B错误;
C、根据电荷守恒可知:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-),故可知溶液中的n(Na+)+n(H+)>n(HCO3-)+n(CO32-)+n(OH-),即阳离子的物质的量大于阴离子的物质的量,故C正确;
D、$\frac{c({H}^{+}).c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$为HCO3-的电离平衡常数,只受温度的影响,温度不变,K不变,故D错误.
故选C.
点评 本题考查了盐类的双水解和溶液中的离子个数的比较,题型较基础,难度不大,应注意掌握盐溶液中的三个守恒.

练习册系列答案
相关题目
10.下列叙述不正确的是( )
| A. | 检验Fe2(SO4)3溶液中是否含有FeSO4的实验操作是:取少量待测液于试管中,滴加1-2滴酸性KMnO4溶液 | |
| B. | 碱金属与卤素所形成的化合物具有熔点较高,能溶于水,水溶液能导电,熔融状态下能导电的性质 | |
| C. | 配制FeCl2溶液的实验操作是:在装有适量固体的大试管中加入适量的蒸馏水,再滴加少量稀盐酸并搅拌,同时加入少量的铁粉 | |
| D. | 向紫色石蕊试液中加入过量的过氧化钠粉末振荡,可观察到溶液中有气泡产生,溶液最终变为无色 |
11.有X、Y、Z、W、Q五种短周期元素,原子序数依次增大,其中X与W同主族,其阴离子与He原子电子层结构相同,Z原子的最外层电子数是次外层电子数的3倍,Y元素是植物最重要的营养元素之一,Q元素的一种氧化物是形成酸雨的主要物质之一.下列有关这五种元素的说法不正确的是( )
| A. | X、Y、Z三种元素既可形成只含共价键的化合物,又可形成既含共价键又含离子键的化合物 | |
| B. | Z、W、Q三种元素所形成的简单离子的半径由大到小的顺序是W>Q>Z | |
| C. | Y的简单氢化物通入Q的氧化物的水化物水溶液中可能生成两种盐 | |
| D. | X与W组成的化合物可与水发生氧化还原反应 |
15.分子式为C5H10O并能与新制的Cu(OH)2浊液反应的有机物有(不含立体异构)( )
| A. | 3种 | B. | 4种 | C. | 6种 | D. | 8种 |
5.镇痛剂M(苯佐卡因)结构简式如图.下列说法正确的是( )
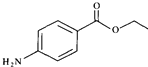

| A. | M分子式为C8H11NO2 | |
| B. | 1 mol M与NaOH溶液反应消耗1 mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
12.某中性有机物(分子式为C10H20O2)在稀硫酸作用下加热得M和N两种有机物,且M在酸性KMnO4溶液作用下可直接得到N.下列说法正确的是( )
| A. | M的分子式为C5H10O | |
| B. | 上述过程发生的所有反应与油脂皂化反应类型相同 | |
| C. | 该中性有机物有4种(不考虑立体异构) | |
| D. | M和N都可以发生取代反应、都能与Na反应生成H2,因此具有相同的官能团 |
10.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,若W原子最外层电子数是其内层电子总数的$\frac{3}{5}$.下列说法中,正确的是( )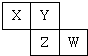

| A. | 元素X是自然界中形成化合物种类最多的元素 | |
| B. | 气态氢化物的稳定性Z>W>Y | |
| C. | 原子半径由大到小排列顺序Z>Y>X | |
| D. | W只有一种氧化物 |




 .
.