题目内容
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,发出苍白色火焰,产物溶于水得到一种强酸.回答下列问题:
(1)写出一种工业制备单质F的化学方程式: .
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,请用离子方程式解释该溶液呈碱性的原因 ;
(3)实验室用F从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如图所示:
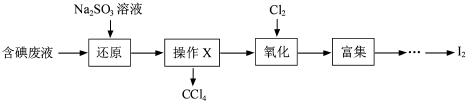
①向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;
②操作X的名称为 .
③已知:5SO32-+2IO3-+2H+═I2+5SO42-+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种.请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在; ;
另从水层取少量溶液,加入1~2mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含有IO3-.(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液.)
(1)写出一种工业制备单质F的化学方程式:
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为
(3)实验室用F从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如图所示:

①向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
②操作X的名称为
③已知:5SO32-+2IO3-+2H+═I2+5SO42-+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种.请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;
另从水层取少量溶液,加入1~2mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含有IO3-.(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液.)
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、D、E、F为短周期元素,B的最外层电子数是其所在周期数的2倍,则B为碳元素,B在D中充分燃烧能生成其最高价化合物BD2,则D为氧元素,E+与D2-具有相同的电子数,则E为钠元素,非金属元素A最外层电子数与其周期数相同,A在F中燃烧,发出苍白色火焰,产物溶于水得到一种强酸,则A为氢元素,F为氯元素,据此答题;
解答:
解:A、B、D、E、F为短周期元素,B的最外层电子数是其所在周期数的2倍,则B为碳元素,B在D中充分燃烧能生成其最高价化合物BD2,则D为氧元素,E+与D2-具有相同的电子数,则E为钠元素,非金属元素A最外层电子数与其周期数相同,A在F中燃烧,发出苍白色火焰,产物溶于水得到一种强酸,则A为氢元素,F为氯元素,
(1)工业上用电解饱和食盐水的方法制备氯气,反应的化学方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(2)C、O、Na组成的一种盐碳酸钠中,钠的质量分数为43%,其俗名为 纯碱(或苏打),在碳酸钠溶液中,碳根离子水解,使溶液呈碱性,离子方程式为CO32-+H2O?HCO3-+OH-,
故答案为:纯碱(或苏打);CO32-+H2O?HCO3-+OH-;
(3)①向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为SO32-+I2+H2O═2H++SO42-+2I-,
故答案为:SO32-+I2+H2O═2H++SO42-+2I-;
②四氯化碳属于有机物,水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法;
故答案为:分液;
③碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:
从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,2I-+2Fe3+=2Fe2++I2,若溶液变蓝色,说明废水中含有I-,否则不含I-;
另从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32-+2IO3-+2H+=I2+5SO42-+H2O,若溶液变蓝色,说明废水中含有IO3-,
否则不含IO3-,
故答案为:从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,若溶液变蓝色,说明废水中含有I-,否则不含I-;
(1)工业上用电解饱和食盐水的方法制备氯气,反应的化学方程式为2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
(2)C、O、Na组成的一种盐碳酸钠中,钠的质量分数为43%,其俗名为 纯碱(或苏打),在碳酸钠溶液中,碳根离子水解,使溶液呈碱性,离子方程式为CO32-+H2O?HCO3-+OH-,
故答案为:纯碱(或苏打);CO32-+H2O?HCO3-+OH-;
(3)①向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为SO32-+I2+H2O═2H++SO42-+2I-,
故答案为:SO32-+I2+H2O═2H++SO42-+2I-;
②四氯化碳属于有机物,水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法;
故答案为:分液;
③碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:
从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,2I-+2Fe3+=2Fe2++I2,若溶液变蓝色,说明废水中含有I-,否则不含I-;
另从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32-+2IO3-+2H+=I2+5SO42-+H2O,若溶液变蓝色,说明废水中含有IO3-,
否则不含IO3-,
故答案为:从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,若溶液变蓝色,说明废水中含有I-,否则不含I-;
点评:本题主要考查了工业制备氯气、盐类水解、氧化还原反应、离子的检验、物质的分离和提纯等知识点,中等难度,元素的推断是解题的关键.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
若用已知浓度的碳酸钠溶液来测定某盐酸溶液的浓度,配制碳酸钠溶液所用碳酸钠中分别含有如下杂质:
①NaOH②NaHCO3③NaCl④K2CO3.所测结果偏低的是( )(已知相对原子质量:H 1,C 12,O 16,Na 23,Cl 35.5 K 39)
①NaOH②NaHCO3③NaCl④K2CO3.所测结果偏低的是( )(已知相对原子质量:H 1,C 12,O 16,Na 23,Cl 35.5 K 39)
| A、① | B、② | C、②③ | D、③④ |
若液氨相当于地球上的水,它可满足木星上生物生存的需要,那么木星上生物体内与地球上生物体内葡萄糖的分子结构相当的化合物是( )
| A、CH2OH-(CHOH)4CHO |
| B、CH2NH2-(CHNH2)4CHO |
| C、CH2NH2-(CHNH2)4CH=NH |
| D、CH2OH-(CHOH)4CH=NH |