题目内容
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化: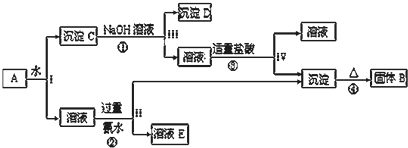
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是 .
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B ;沉淀C ;沉淀D .
(3)写出①、②、④三个反应方程式(属于离子反应的写离子方程式)
① ;
② ;
④ .

据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B
(3)写出①、②、④三个反应方程式(属于离子反应的写离子方程式)
①
②
④
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀C为Al2O3和Fe2O3;
由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中加适量的盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向KAl(SO4)2溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为K2SO4、(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,然后结合物质的性质及化学用语来解答.
由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中加适量的盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向KAl(SO4)2溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为K2SO4、(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,然后结合物质的性质及化学用语来解答.
解答:
解:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀C为Al2O3和Fe2O3;
由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中加适量的盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为K2SO4、(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,
(1)溶液和沉淀的分离利用过滤,故答案为:过滤;
(2)由上述分析可知B为Al2O3,C为Al2O3、Fe2O3,D为Fe2O3 溶液E为K2SO4、(NH4)2SO4,
故答案为:Al2O3;Al2O3、Fe2O3;Fe2O3;
(3)反应①为Al2O3+2NaOH+3H2O=2Na[Al(OH)4],即Al2O3+2OH-+3H2O=2[Al(OH)4]-,
反应②为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
反应④为2Al(OH)3
Al2O3+3H2O,
故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al(OH)3
Al2O3+3H2O.
由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中加适量的盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为K2SO4、(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,
(1)溶液和沉淀的分离利用过滤,故答案为:过滤;
(2)由上述分析可知B为Al2O3,C为Al2O3、Fe2O3,D为Fe2O3 溶液E为K2SO4、(NH4)2SO4,
故答案为:Al2O3;Al2O3、Fe2O3;Fe2O3;
(3)反应①为Al2O3+2NaOH+3H2O=2Na[Al(OH)4],即Al2O3+2OH-+3H2O=2[Al(OH)4]-,
反应②为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
反应④为2Al(OH)3
| ||
故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;2Al(OH)3
| ||
点评:本题考查混合物的分离,为高频考点,综合考查元素化合物性质,侧重Al、Fe及其化合物性质的考查,注意氧化铝的两性,明确发生的化学反应为解答的关键,题目难度中等.

练习册系列答案
相关题目
下列关于乙酸的说法不正确的是( )
| A、乙酸分子中含有碳氧双键,所以乙酸能使酸性高锰酸钾溶液褪色 |
| B、乙酸俗称醋酸,无水乙酸又称为冰醋酸,它是纯净物 |
| C、乙酸是重要的有机酸,是一种有刺激性气味的液体 |
| D、可以用乙酸除去热水瓶中的水垢 |
在密闭容器中发生如下反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后,W的浓度为0.5mol?L-1,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为0.8mol?L-1.下列叙述不正确的是( )
| A、平衡向逆反应方向移动 |
| B、a+b>c+d |
| C、Z的体积分数减少 |
| D、X的转化率减小 |
储氢合金表面镀铜过程发生反应Cu2++2HCHO+4OH-=Cu+H2↑+2H2O+2HCOO-,下列说法错误的是( )
| A、电镀过程中氢气在镀件表面析出 |
| B、电镀时溶液中Cu2+移向阴极,并在阴极上发生还原反应 |
| C、阳极反应式为HCHO+3OH--2e-=2H2O+HCOO- |
| D、电镀时每生成6.4g铜,镀层放出2.24L H2 |

 G.
G. 和
和