题目内容
浙江省宁波市金田电解铜厂,在电解铜的阳极泥中含有3~14%X元素,其余为稀有金属及贵金属.X和硫同主族,人体缺少X就会得“克山病”,X也是制光电池的一种原料.从阳极泥中提取X的流程如下:
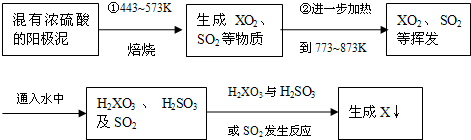
(1)X的元素符号是 X的原子结构示意图
(2)阳极泥中X以X单质、Ag2X、Cu2X等型体存在,则①中X单质与浓硫酸的反应方程式为 ,Cu2X与浓硫酸的反应方程式为 .
(3)H2XO3 与SO2的反应方程式为 .

(1)X的元素符号是
(2)阳极泥中X以X单质、Ag2X、Cu2X等型体存在,则①中X单质与浓硫酸的反应方程式为
(3)H2XO3 与SO2的反应方程式为
考点:物质分离和提纯的方法和基本操作综合应用,电解原理
专题:实验设计题,元素及其化合物
分析:(1)根据X和硫同主族,人体缺少X就会得“克山病”,X也是制光电池的一种原料来分析;
(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,由此可得出化学方程式;Cu2X与浓硫酸的反应硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,由此可得出化学方程式;
(3)根据流程图可知H2SeO3与SO2的反应,硒的氧化产物为Se,SO2的还原产物为硫酸,由此可得出化学方程式;
(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,由此可得出化学方程式;Cu2X与浓硫酸的反应硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,由此可得出化学方程式;
(3)根据流程图可知H2SeO3与SO2的反应,硒的氧化产物为Se,SO2的还原产物为硫酸,由此可得出化学方程式;
解答:
解:(1)因为X和硫同主族,人体缺少X就会得“克山病”,X也是制光电池的一种原料,实验X元素符号是Se,原子的结构示意图为: ;故答案为:Se,
;故答案为:Se, ;
;
(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,所以该反应方程式为:Se+2H2SO4(浓)
SeO2↑+2SO2↑+2H2O,Cu2X与浓硫酸的反应方程式为:Cu2Se+6H2SO4=2CuSO4+SeO2+4SO2+6H2O
故答案为:Se+2H2SO4(浓)
SeO2↑+2SO2↑+2H2O;Cu2Se+6H2SO4=2CuSO4+SeO2+4SO2+6H2O;
(3)根据题意知,二氧化硫还原亚硒酸生成硒单质,二氧化硫被氧化生成硫酸,化学方程式为:H2SeO3+2SO2+H2O=Se+2H2SO4,故答案为:H2SeO3+2SO2+H2O=Se+2H2SO4;
 ;故答案为:Se,
;故答案为:Se, ;
;(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,所以该反应方程式为:Se+2H2SO4(浓)
| ||
故答案为:Se+2H2SO4(浓)
| ||
(3)根据题意知,二氧化硫还原亚硒酸生成硒单质,二氧化硫被氧化生成硫酸,化学方程式为:H2SeO3+2SO2+H2O=Se+2H2SO4,故答案为:H2SeO3+2SO2+H2O=Se+2H2SO4;
点评:本题以电解原理为载体考查了电解铜的阳极泥中Se的提取,明确流程是解本题关键,结合物质的性质分析解答书写方程式,注意运用题给信息,难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
将铁片加到1L 0.5mol?L-1 FeCl3溶液中,当Fe2+和Fe3+的浓度相等时,铁片的质量为( )
| A、2.8g | B、5.6g |
| C、11.2g | D、1.4g |
在密闭容器中发生如下反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后,W的浓度为0.5mol?L-1,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为0.8mol?L-1.下列叙述不正确的是( )
| A、平衡向逆反应方向移动 |
| B、a+b>c+d |
| C、Z的体积分数减少 |
| D、X的转化率减小 |