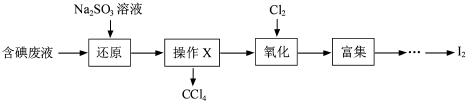
题目内容
碳酸锂广泛应用于陶瓷和医药等领域.已知β?锂辉石(主要成分为Li2O?Al2O3?4SiO2)为原材料制备Li2CO3的工艺流程如图:
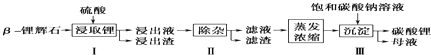
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液.
(1)步骤Ⅰ前,β锂辉石要粉碎成细颗粒的目的是
(2)加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有 .
(4)步骤Ⅲ中,生成沉淀的离子方程式为 .
(5)从母液中可回收的主要物Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.

已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入
(1)步骤Ⅰ前,β锂辉石要粉碎成细颗粒的目的是
(2)加入
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有
(4)步骤Ⅲ中,生成沉淀的离子方程式为
(5)从母液中可回收的主要物Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:已知β-锂辉石(主要成分为Li2O?Al2O3?4SiO2)为原材料制备Li2CO3的工艺流程:Li2O?Al2O3?4SiO2加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,在在搅拌下加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,过滤,再将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,Fe2+被氧化为Fe3+,然后转化为氢氧化铁沉淀,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,过滤的硫酸锂溶液,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂;
(1)从反应速率的角度来分析;
(2)抓住题目中的“酸性溶液”,“调节溶液的pH到6.0~6.5”,从所给试剂中选择符合条件的药品;
(3)H2O2是强氧化剂,可把Fe2+氧化成Fe3+,石灰乳和碳酸钠都是沉淀剂,使溶液中的Fe2+、Mg2+、Ca2+;
(4)步骤Ⅲ加入饱和Na2CO3溶液后,主要使Li+转化为Li2CO3沉淀.
(1)从反应速率的角度来分析;
(2)抓住题目中的“酸性溶液”,“调节溶液的pH到6.0~6.5”,从所给试剂中选择符合条件的药品;
(3)H2O2是强氧化剂,可把Fe2+氧化成Fe3+,石灰乳和碳酸钠都是沉淀剂,使溶液中的Fe2+、Mg2+、Ca2+;
(4)步骤Ⅲ加入饱和Na2CO3溶液后,主要使Li+转化为Li2CO3沉淀.
解答:
解:已知β-锂辉石(主要成分为Li2O?Al2O3?4SiO2)为原材料制备Li2CO3的工艺流程:Li2O?Al2O3?4SiO2加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,在在搅拌下加入石灰石调节pH,使Al3+、Fe3+转化为氢氧化物沉淀,过滤,再将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,Fe2+被氧化为Fe3+,然后转化为氢氧化铁沉淀,镁离子转化为氢氧化镁沉淀,钙离子转化为碳酸钙沉淀,过滤的硫酸锂溶液,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂;
(1)固体颗粒越小,化学反应速率越快,同时可使锂元素尽可能多地溶解到酸中,
故答案为:增大固液接触面积,加快浸出反应速率,提高浸出率;
(2)所给三种物质中,只有CaCO3能够降低溶液的酸度,提高溶液的pH到6.0~6.5,可除去Fe3+、Al3+,
故答案为:石灰石;
(3)步骤Ⅱ中加入H2O2溶液,可将Fe2+氧化为Fe3+,然后加入石灰乳可除去其中的Fe3+和Mg2+,再加入Na2CO3溶液可除去Ca2+.此时溶液中的离子主要有Li+、Na+、SO42-,
故答案为:Fe2+、Mg2+、Ca2+;
(4)步骤Ⅲ加入饱和Na2CO3溶液后,主要使Li+转化为Li2CO3沉淀,反应的离子方程式为:2Li++CO32-=Li2CO3↓;
故答案为:2Li++CO32-=Li2CO3↓.
(1)固体颗粒越小,化学反应速率越快,同时可使锂元素尽可能多地溶解到酸中,
故答案为:增大固液接触面积,加快浸出反应速率,提高浸出率;
(2)所给三种物质中,只有CaCO3能够降低溶液的酸度,提高溶液的pH到6.0~6.5,可除去Fe3+、Al3+,
故答案为:石灰石;
(3)步骤Ⅱ中加入H2O2溶液,可将Fe2+氧化为Fe3+,然后加入石灰乳可除去其中的Fe3+和Mg2+,再加入Na2CO3溶液可除去Ca2+.此时溶液中的离子主要有Li+、Na+、SO42-,
故答案为:Fe2+、Mg2+、Ca2+;
(4)步骤Ⅲ加入饱和Na2CO3溶液后,主要使Li+转化为Li2CO3沉淀,反应的离子方程式为:2Li++CO32-=Li2CO3↓;
故答案为:2Li++CO32-=Li2CO3↓.
点评:本题以制备Li2CO3的工艺流程为知识背景,考查了影响速率的因素、除杂质、离子方程式等,题目难度中等,侧重于考查学生对题中信息的分析和利用能力.

练习册系列答案
相关题目
用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)( )
| A、酸式滴定管未用标准盐酸润洗 |
| B、滴定过程中不慎有液体溅出 |
| C、滴定前仰视读数,滴定后读数正确 |
| D、碱式滴定管未用待测液润洗 |
将铁片加到1L 0.5mol?L-1 FeCl3溶液中,当Fe2+和Fe3+的浓度相等时,铁片的质量为( )
| A、2.8g | B、5.6g |
| C、11.2g | D、1.4g |
下列关于乙酸的说法不正确的是( )
| A、乙酸分子中含有碳氧双键,所以乙酸能使酸性高锰酸钾溶液褪色 |
| B、乙酸俗称醋酸,无水乙酸又称为冰醋酸,它是纯净物 |
| C、乙酸是重要的有机酸,是一种有刺激性气味的液体 |
| D、可以用乙酸除去热水瓶中的水垢 |
可用于鉴别氯化钾、盐酸、氢氧化钾三种溶液的试剂是( )
| A、AgNO3溶液 |
| B、紫色石蕊试液 |
| C、Na2CO3溶液 |
| D、淀粉碘化钾溶液 |