题目内容
7.常温常压下,aml 三种气态烃以任意比混合后,和足量O2混合点燃,恢复到原状态后,测得气体体积共缩小 2aml( 不考虑CO2的溶解).则三种烃可能的组合( )| A. | C3H8、C4H8、C4H6 | B. | CH4、C3H6、C2H2 | C. | C2H6、C3H6、C4H6 | D. | C2H4、CH4、C3H4 |
分析 设烃的平均分子式为CxHy,则:CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,由体积变化可知:△V=(1+x+$\frac{y}{4}$)-(x+$\frac{y}{2}$)=1+$\frac{y}{4}$=2,解得y=4,则混合物平均含有4个H原子,三种气态烃以任意比混合,则三者分子中H原子数目都为4,据此进行解答.
解答 解:设烃的平均分子式为CxHy,则:
CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O△V
1 (x+$\frac{y}{4}$) x $\frac{y}{2}$ 1+$\frac{y}{4}$
amL 2amL
所以amL:2amL=1:(1+$\frac{y}{4}$),解得:y=4,
则混合物平均含有4个H原子,三种气态烃以任意比混合,则三者分子中H原子数目都为4,则:
A.C3H8、C4H8、C4H6的H原子平均值大于4,不符合,故A错误;
B.CH4、C3H6、C2H2中H原子平均值可能为4,也可能不为4,不符合任意比,故B错误;
C.C2H6、C3H6、C4H6H原子平均值为6,不符合,故C错误;
D.C2H4、CH4、C3H4以任意比混合,H原子平均值都为4,符合题意,故D正确;
故选D.
点评 本题考混合物的有关计算,题目难度中等,注意利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法,B选项为易错点,学生容易忽略任意比,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
17.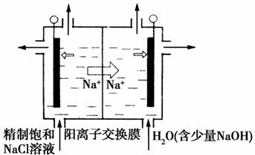 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
(1)①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:Cl--5e-+2H2O=ClO2↑+4H+.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为0.01mol.
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子.电池工作时正极反应为O2+4e-=2O2-.
(3)若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为0.1mol.
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.(1)①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:Cl--5e-+2H2O=ClO2↑+4H+.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为0.01mol.
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子.电池工作时正极反应为O2+4e-=2O2-.
(3)若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
18.NA为阿伏伽徳罗常数的值,下列说法正确的是( )
| A. | 1L 1mol/L的稀硝酸中,氧原子数为3NA | |
| B. | 常温常压下的67.2L氯气与54g铝充分反应,转移电子数为6NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电数为0.2NA | |
| D. | 标准状况下,80gSO3,中含3NA心个氧原子,体积约为22.4L |
15.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1molFe与足量的Cl2反应转移的电子数为2NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | 常温、常压下,22gCO2中含有的氧原子数为NA | |
| D. | 0.11mol/LCaCl2溶液中含氧离子数为0.2NA |
19.下列实验装置不能达到实验目的是( )
| A. |  用SO2做喷泉实验 | B. |  干燥氯气 | ||
| C. |  验证NH3易溶于水 | D. |  比较Na2CO3与NaHCO3的稳定性 |
16.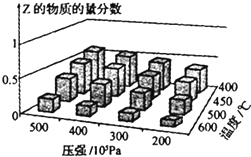 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )| A. | △H>0 | |
| B. | 升温,正、逆反应速率都增大,平衡常数减小 | |
| C. | 增大压强,Z的含量减小 | |
| D. | 在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小 |
17.下列关于钠的说法正确的是( )
| A. | 钠是银白色金属、密度比水略大 | |
| B. | 钠着火时,可用水灭火 | |
| C. | 金属钠在空气中燃烧,生成氧化钠 | |
| D. | 通常情况下,钠的熔点略低于水的沸点 |
 ;
;