题目内容
16.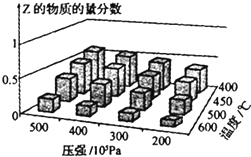 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )| A. | △H>0 | |
| B. | 升温,正、逆反应速率都增大,平衡常数减小 | |
| C. | 增大压强,Z的含量减小 | |
| D. | 在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小 |
分析 由图象可知,降低温度,Z的物质的量分数增大,说明降低温度平衡向正反应方向移动,所以正反应是放热的,则△H<0,
降低压强,Z的物质的量分数减小,说明压强减小,平衡向着逆反应方向移动,减小压强,化学平衡是向着气体系数和增加的方向进行的,所以有m+n>c,由此分析解答.
解答 解:由图象可知,降低温度,Z的物质的量分数增大,说明降低温度平衡向正反应方向移动,所以正反应是放热的,则△H<0,
降低压强,Z的物质的量分数减小,说明压强减小,平衡向着逆反应方向移动,减小压强,化学平衡是向着气体系数和增加的方向进行的,所以有m+n>c,
A.根据分析可知,△H<0,故A错误;
B.升高温度正逆反应速率都加快,但因正反应是放热反应,所以平衡常数减小,故B正确;
C.增大压强,平衡向着正向移动,Z的含量增大,故C错误;
D.在恒温恒容条件下,向已达到平衡的体系中加入少量Z,相当于增大压强,平衡向着正向移动,Z的百分含量增大,故D错误;
故选B.
点评 本题考查化学平衡的计算,题目难度中等,解答本题的关键是能正确分析图象曲线的变化趋势,注意掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.常温常压下,aml 三种气态烃以任意比混合后,和足量O2混合点燃,恢复到原状态后,测得气体体积共缩小 2aml( 不考虑CO2的溶解).则三种烃可能的组合( )
| A. | C3H8、C4H8、C4H6 | B. | CH4、C3H6、C2H2 | C. | C2H6、C3H6、C4H6 | D. | C2H4、CH4、C3H4 |
11.用0.1000mol•L-1NaOH溶液滴定未知浓度的HCl溶液,下列叙述正确的是( )
| A. | 酸式滴定管在装酸液前未用待装液润洗2~3次,使测定结果偏大 | |
| B. | 滴定终点时,俯视读数,使测定结果偏小 | |
| C. | 只能选用酚酞作指示剂 | |
| D. | 滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点 |
1.用电解的方法可除去溶液中的NO3-,其原理如图所示,下列说法中正确的是( )
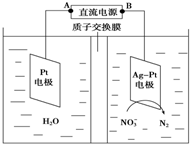

| A. | 铅蓄电池的B极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池工作过程中负极质量增加 | |
| C. | 该电解池的阳极反应为:2 NO3-+6H2O-10e-═N2↑+12OH- | |
| D. | 若电解过程中转移10mol电子,则生成N2的体积为22.4L |
8.对于易燃、易爆、有毒的化学物质,往往会在其包装上贴危险警告标签,下面物质贴错标签的是( )
| A | B | C | D | |
| 物质的 化学式 | NaOH(浓) | C2H5OH(酒精) | H2SO4 (浓) | NH4NO3 |
| 危险警 告标签 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
5. 向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol•L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( )
向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol•L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( )
 向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol•L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( )
向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol•L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( )| A. | 0.005 mol•L-1 | B. | 0.01 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.1 mol•L-1 |
6.常温下,下列不发生反应的一组物质是( )
①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与纯碱 ⑤铁与液氧 ⑥一氧化氮与氧气 ⑦硅与氧气.
①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与纯碱 ⑤铁与液氧 ⑥一氧化氮与氧气 ⑦硅与氧气.
| A. | ①②③⑥ | B. | ②③⑤⑥ | C. | ①④⑤⑦ | D. | ①②③⑦ |
 ⑤
⑤ ⑧
⑧ ⑨
⑨ .
.