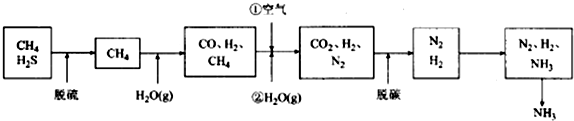
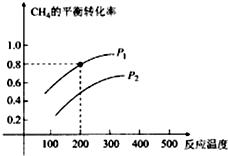
题目内容
2.把7.8g铝和镁的混合物粉末放入200mL盐酸中,恰好完全反应,并得到标准状况下8.96LH2,则:(1)该合金中铝的物质的量为0.2mol;
(2)该合金中镁的物质的量为2.4g;
(3)盐酸的物质的量浓度为4 mol/L.
分析 发生反应:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,设Mg、Al的物质的量分别为xmol、ymol,根据方程式表示出消耗HCl、生成氢气的物质的量,根据二者质量与生成氢气的体积列方程计算Mg、Al的物质的量;
(1)根据分析可得出混合物中铝的物质的量;
(2)根据m=nM计算Mg的质量;
(2)根据c=$\frac{n}{V}$计算出该盐酸的物质的量浓度.
解答 解:标况下8.96L氢气的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,
设7.8g镁铝合金中含有镁xmol,含有铝ymol,则:
Mg+2HCl=MgCl2+H2↑,
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑,
2 6 3
y 3y $\frac{3}{2}$y
根据合金质量及生成氢气的物质的量可知:$\left\{\begin{array}{l}{24x+27y=7.8}\\{x+\frac{3}{2}y=0.4}\end{array}\right.$,
解得:x=0.1、y=0.2,
(1)根据分析可知,合金中Al的物质的量为0.2mol,
故答案为:0.2;
(2)Mg的质量=0.1mol×24g/mol=2.4g,
故答案为:2.4g;
(2)反应消耗的盐酸的总物质的量为:0.1mol×2+0.2mol×3=0.8mol,
该盐酸的物质的量浓度为:c(HCl)=$\frac{0.8mol}{0.2L}$=4mol/L,
故答案为:4.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积等之间的关系,试题培养了学生的分析能力及化学计算能力.

| A. | Fe与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 实验室制备氢氧化铝:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 铜与稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
| A. | C3H8、C4H8、C4H6 | B. | CH4、C3H6、C2H2 | C. | C2H6、C3H6、C4H6 | D. | C2H4、CH4、C3H4 |
| 甲 | 乙 | 丙 | 丁 | |
| A | 2 | 1 | 2 | 1 |
| B | 1 | 1 | 2 | 2 |
| A. | A的转化率为:甲<丙<乙<丁 | B. | A的转化率为:甲<乙<丙<丁 | ||
| C. | B的转化率为:甲>丙>乙>丁 | D. | B的转化率为:丁>乙>丙>甲 |
| A. | 酸式滴定管在装酸液前未用待装液润洗2~3次,使测定结果偏大 | |
| B. | 滴定终点时,俯视读数,使测定结果偏小 | |
| C. | 只能选用酚酞作指示剂 | |
| D. | 滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点 |
| A. | 胶体 | B. | 溶液 | C. | 悬浊液 | D. | 乳浊液 |
 .
.