题目内容
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A、VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B、外电路中电子由c电极流向VB2电极 |
| C、电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D、若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05mol/L |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,电池总反应为:N2H4+O2=N2↑+2H2O,则与负极相连的c为电解池的阴极,铜离子得电子发生还原反应,与氧气相连的b为阳极,氢氧根失电子发生氧化反应,据此分析计算.
解答:
解:A、负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O,故A错误;
B、外电路中电子由VB2电极流向阴极c电极,故B错误;
C、电解过程中,与氧气相连的b为阳极,氢氧根失电子生成氧气,故C错误;
D、当外电路中通过0.04mol电子时,B装置内与氧气相连的b为阳极,氢氧根失电子生成氧气为0.01mol,又共收集到0.448L气体即
=0.02mol,则阴极也产生0.01moL的氢气,所以溶液中的铜离子为
=0.01mol,则CuSO4溶液的物质的量浓度为
=0.05mol/L,故D正确;
故选D.
B、外电路中电子由VB2电极流向阴极c电极,故B错误;
C、电解过程中,与氧气相连的b为阳极,氢氧根失电子生成氧气,故C错误;
D、当外电路中通过0.04mol电子时,B装置内与氧气相连的b为阳极,氢氧根失电子生成氧气为0.01mol,又共收集到0.448L气体即
| 0.448L |
| 22.4L/mol |
| 0.04-0.01×2 |
| 2 |
| 0.01 |
| 0.2 |
故选D.
点评:本题考查原电池及其电解池的工作原理,题目难度不大,本题注意把握电极反应式的书写,利用电子守恒计算.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
单质或化合物A可能为Na、C、Si、N2、H2S,可以实现下列转化关系的有( )


| A、2种 | B、3种 | C、4种 | D、5种 |
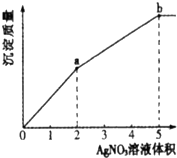 往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是( )
往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是( )| A、KSP(AgCl)<KSP(AgI) |
| B、c( Cl-):c( I-)=3:2 |
| C、m( AgCl ):m( AgI )=2:3 |
| D、a~b段产生黄色沉淀 |
对于某酸性溶液(可能含有Br-、SO4 2-、HSO3-、NH4+ ),分别进行如下实验:①加热时放出的气体可使品红溶液褪色;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略呈橙红色;④加入BaCl2液和稀硝酸,产生不溶于稀硝酸的白色沉淀.对于下列微粒不能确定其在原溶液中是否存在的是( )
| A、Br- |
| B、SO42- |
| C、HSO3- |
| D、NH4+ |
下列说法正确的是( )
| A、乙烯和甲烷都能发生加成反应 |
| B、CuSO4溶液能使鸡蛋清盐析而沉淀 |
| C、米酒变酸是因为乙醇被氧化为乙酸 |
| D、HNO3不能与苯发生取代反应 |
