题目内容
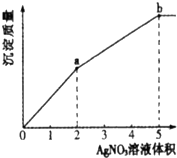 往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是( )
往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是( )| A、KSP(AgCl)<KSP(AgI) |
| B、c( Cl-):c( I-)=3:2 |
| C、m( AgCl ):m( AgI )=2:3 |
| D、a~b段产生黄色沉淀 |
考点:离子方程式的有关计算
专题:
分析:氯化银相对分子质量小于碘化银,依据图象0-a、a-b段斜率可知,0-a生成的为碘化银,a-b段生成为氯化银,依据根据发生反应:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓判断原溶液中n(I-)、n(Cl-),依据消耗的硝酸银的体积判断生成m( AgCl ):m( AgI ),据此解答.
解答:
解:氯化银相对分子质量小于碘化银,依据图象0-a、a-b段斜率可知,0-a生成的为碘化银,a-b段生成为氯化银,
A.依据溶度积规则,可知向含Cl-和I-的稀溶液中滴入AgNO3溶液,先产生碘化银,说明碘化银溶解度小于氯化银,所以KSP(AgCl)>KSP(AgI),故A错误;
B.从图象可知,反应碘离子消耗硝酸银2体积,反应氯离子消耗硝酸银3体积,依据方程式:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓可知n(I-):n(Cl-),而氯离子、碘离子在同一溶液中,所以c( Cl-):c( I-)=3:2,故B正确;
C.从图象可知,反应碘离子消耗硝酸银2体积,反应氯离子消耗硝酸银3体积,依据方程式:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓可知n(I-):n(Cl-),所以生成碘化银和氯化银的物质的量之比为:n( AgCl ):n( AgI )=3:2,m( AgCl ):m( AgI )=3×143.5:2×162.5≠2:3,故C错误;
D.往含Cl-和I-的稀溶液中滴入AgNO3溶液,先发生I-+Ag+=AgI↓,0-a段,生成的碘化银为黄色沉淀,故D错误;
故选:B.
A.依据溶度积规则,可知向含Cl-和I-的稀溶液中滴入AgNO3溶液,先产生碘化银,说明碘化银溶解度小于氯化银,所以KSP(AgCl)>KSP(AgI),故A错误;
B.从图象可知,反应碘离子消耗硝酸银2体积,反应氯离子消耗硝酸银3体积,依据方程式:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓可知n(I-):n(Cl-),而氯离子、碘离子在同一溶液中,所以c( Cl-):c( I-)=3:2,故B正确;
C.从图象可知,反应碘离子消耗硝酸银2体积,反应氯离子消耗硝酸银3体积,依据方程式:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓可知n(I-):n(Cl-),所以生成碘化银和氯化银的物质的量之比为:n( AgCl ):n( AgI )=3:2,m( AgCl ):m( AgI )=3×143.5:2×162.5≠2:3,故C错误;
D.往含Cl-和I-的稀溶液中滴入AgNO3溶液,先发生I-+Ag+=AgI↓,0-a段,生成的碘化银为黄色沉淀,故D错误;
故选:B.
点评:本题为图象题考查了离子反应的有关计算,明确溶度积规则及各段发生的反应是解题关键,题目难度中等.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0 mol?L-1 KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、能溶解Al2O3的溶液:Na+、K+、Cl-、SiO32- |
| C、无色透明溶液中:Al3+、Cu2+、Cl-、HCO3- |
| D、使甲基橙变红色的溶液:Mg2+、K+、Cl-、SO42- |
下列溶液中,微粒浓度关系一定正确的是( )
| A、pH=6的纯水:c(OH-)<c(H+) |
| B、0.1mol?L-1的(NH4)2SO4溶液:c(NH4+)>c(SO42-)>c(H+) |
| C、常温下,pH=7的醋酸与醋酸钠的混合溶液:c(CH3COO-)>c(Na+) |
| D、常温下,pH=2的一元酸和pH=12的一元强碱等体积混合后所得溶液:c(OH-)=c(H+) |
化学与生产和生活、军事、科研产品紧密相关,下列说法错误的是( )
| A、家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 |
| B、在牙膏中添入Na2PO3F、NaF能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的 |
| C、侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异 |
| D、可用蘸浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
下列有关的说法正确的是( )
| A、升高Fe2(SO4)3溶液的温度,其中水的离子积常数和pH均增加 |
| B、相同温度下1L 0.1mol.L-1NaF溶液跟1L 0.1mol.L-1NaCl溶液中所含离子总数不相等 |
| C、在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液红色褪去,说明BaCl2溶液显酸性 |
| D、铅蓄电池放电时的负极和充电时的阴极匀发生还原反应 |
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A、VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B、外电路中电子由c电极流向VB2电极 |
| C、电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D、若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05mol/L |
阿魏酸在食品、医药等方面有着广泛用途.一种合成阿魏酸的反应可表示为:下列说法正确的是( )

| A、阿魏酸的分子式为C10H10O4 |
| B、香兰素、阿魏酸均可与NaOH、NaHCO3溶液反应 |
| C、可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成 |
| D、一定条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 |
下列各溶液中一定能大量共存的离子组是( )
| A、加入铝粉有氢气生成的溶液中:Mg2+、Cu2-、SO42-、K+ |
| B、使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- |
| C、c(Fe3+)=0.1mol/L的溶液中:Na+、SCN-、S2-、SO32- |
| D、无色溶液中:K+、Na+、HCO3-、Ca2+ |
