题目内容
对于某酸性溶液(可能含有Br-、SO4 2-、HSO3-、NH4+ ),分别进行如下实验:①加热时放出的气体可使品红溶液褪色;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略呈橙红色;④加入BaCl2液和稀硝酸,产生不溶于稀硝酸的白色沉淀.对于下列微粒不能确定其在原溶液中是否存在的是( )
| A、Br- |
| B、SO42- |
| C、HSO3- |
| D、NH4+ |
考点:离子反应发生的条件
专题:离子反应专题
分析:二氧化硫气体可以使品红溶液褪色,氨气能使湿润的红色石蕊试纸变蓝,硫酸钡是不溶于硝酸的白色沉淀,以此解答该题.
解答:
解:①加热,放出的气体可以使品红溶液褪色,证明其中含有HSO3-;
②取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝,证明含有NH4+;
③取原溶液加氯水,溶液略显橙红色,则含有溴离子;
④再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,证明含有硫酸根,但是在亚硫酸存在的前提下,亚硫酸也会被硝酸氧化为硫酸,所以不能确认硫酸根在原溶液中是否存在,故选B.
②取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝,证明含有NH4+;
③取原溶液加氯水,溶液略显橙红色,则含有溴离子;
④再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,证明含有硫酸根,但是在亚硫酸存在的前提下,亚硫酸也会被硝酸氧化为硫酸,所以不能确认硫酸根在原溶液中是否存在,故选B.
点评:本题考查常见阴离子的检验,为高频考点,侧重于学生的分析能力的考查,难度不大,注意掌握常见阴离子的检验方法,并会设计合理的实验.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
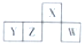 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,且4种元素最外层电子数之和与Ca2+的核外电子数相等.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,且4种元素最外层电子数之和与Ca2+的核外电子数相等.下列判断正确的是( )| A、元素X、Z的原子半径大小:X>Z |
| B、含Y元素的盐溶液有的显酸性,有的显碱性 |
| C、Y、W的简单氢化物中氢元素的化合价相同 |
| D、钙与W可以形成CaW2化合物,且化合物中含有离子键 |
化学与生产和生活、军事、科研产品紧密相关,下列说法错误的是( )
| A、家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 |
| B、在牙膏中添入Na2PO3F、NaF能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的 |
| C、侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异 |
| D、可用蘸浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A、VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B、外电路中电子由c电极流向VB2电极 |
| C、电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D、若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05mol/L |
用下列实验装置进行相应实验,合理的是( )


| A、用图(1)所示装置除去CO2中含有的少量SO2 |
| B、用图(2)所示装置蒸干AlCl3饱和溶液制备无水AlCl3固体 |
| C、用图(3)所示装置分离饱和Na2CO3溶液和乙酸乙酯的混合物 |
| D、用图(4)所示装置氨气 |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、1 mol[Cu(NH3)4]2+ 中含有σ键的数目为12NA |
| B、0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA |
| C、分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA |
| D、用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA |
下列原子序数所代表的元素中,全属于主族元素的是( )
| A、22 26 11 |
| B、13 15 38 |
| C、29 31 16 |
| D、18 21 31 |
 (1)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是
(1)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是