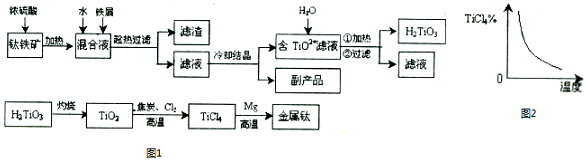
题目内容
14.苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应: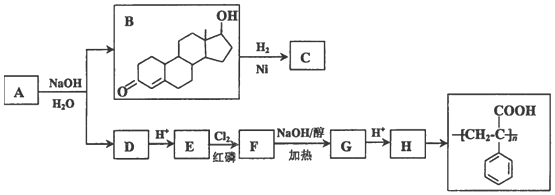
已知反应:
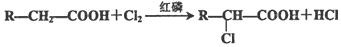
根据以上信息回答下列问题:
(1)A中所含官能团的名称是酯基、碳碳双键、羰基;B的分子式是C18H26O2.
(2)B→C的反应类型是加成反应;E→F的反应类型是取代反应.
(3)D的结构简式是
 .
.(4)F→G的化学方程式是
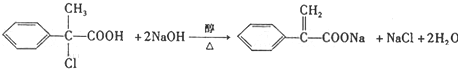 .
.(5)H中最多有9个碳原子在同一个平面上.
(6)芳香族化合物X是F的同分异构体,请写出X的两种符合下列条件的结构简式:
①1mol最多能和3molNaOH发生反应
②苯环上的氢只有两种
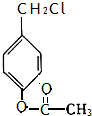 、
、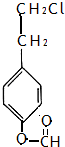 .
.
分析 A和氢氧化钠的水溶液发生水解反应生成B和D,B和氢气发生加成反应生成C为 ,
,
D和酸反应生成E,D为羧酸钠盐,E是羧酸,E和氯气、红磷反应生成F,F和氢氧化钠的醇溶液发生消去反应生成G,G与酸反应生成H,由H发生加聚反应的产物可知H为 ,则G为
,则G为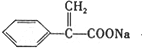 ,F是
,F是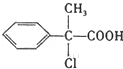 ,E是
,E是 ,D是
,D是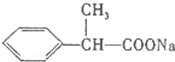 ,则A为
,则A为 ,据此解答.
,据此解答.
解答 解:A和氢氧化钠的水溶液发生水解反应生成B和D,B和氢气发生加成反应生成C为 ,
,
D和酸反应生成E,D为羧酸钠盐,E是羧酸,E和氯气、红磷反应生成F,F和氢氧化钠的醇溶液发生消去反应生成G,G与酸反应生成H,由H发生加聚反应的产物可知H为 ,则G为
,则G为 ,F是
,F是 ,E是
,E是 ,D是
,D是 ,则A为
,则A为 ,
,
(1)A为 ,A中所含官能团的名称是 酯基、碳碳双键、羰基,根据B的结构简式可知,B的分子式是C18H26O2,
,A中所含官能团的名称是 酯基、碳碳双键、羰基,根据B的结构简式可知,B的分子式是C18H26O2,
故答案为:酯基、碳碳双键、羰基;C18H26O2;
(2)B→C是B与氢气发生加成反应生成D,E→F的反应类型是:E中H原子被Cl原子确定生成F,属于取代反应,故答案为:加成反应;取代反应;
(3)由上述分析可知,D的结构简式为 ,故答案为:
,故答案为: ;
;
(4)F→G的化学方程式是: ,
,
故答案为: ;
;
(5)H为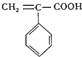 ,苯环、碳碳双键、羧基都是平面结构,所有平面可以共面,故所有的碳原子都可能处于同一平面,即H中最多有9个碳原子在同一个平面上,故答案为:9;
,苯环、碳碳双键、羧基都是平面结构,所有平面可以共面,故所有的碳原子都可能处于同一平面,即H中最多有9个碳原子在同一个平面上,故答案为:9;
(6)芳香族化合物X是F( )的同分异构体,两种符合下列条件的结构简式:
)的同分异构体,两种符合下列条件的结构简式:
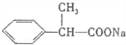
A.1mol X最多能和3molNaOH发生反应,应含有甲酸与酚形成的酯基,B.苯环上的氢只有两种,有2个侧链且处于对位,为: 、
、 等,
等,
故答案为: 、
、 .
.
点评 本题考查有机物推断、有机反应类型、官能团及性质、同分异构体等,由H形成的高聚物的结构采取逆推法推断,需要学生熟练掌握官能团的性质,难度中等.

练习册系列答案
相关题目
4.把金属钠投入到下列稀溶液中,溶液质量会减轻的是( )
| A. | HCl | B. | (NH4)2SO4 | C. | CaCl2 | D. | CuSO4 |
5.下列有关物质的性质与应用相对应的是( )
| A. | 碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 | |
| B. | 铝易发生钝化,可用于作飞机、火箭的结构材料 | |
| C. | 炭具有还原性,可用于冶炼钠、镁、铝等金属 | |
| D. | 浓硫酸具有强氧化性,可用于干燥二氧化硫气体 |
19.对于相应化学用语的推论合理的是( )
| 选项 | 化学用语 | 推论 |
| A | ${\;}_{92}^{238}$U3+ | 该铀离子核外有89个电子 |
| B | 2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol | 1mol氢气完全燃烧放出热量483.6kJ. |
| C | 2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ | NaCl氧化性比Cl2强 |
| D | FeO+4H++NO3-═Fe3++NO2↑+2H2O | 氧化亚铁溶于稀硝酸的离子方程式 |
| A. | A | B. | B | C. | C | D. | D |
6.(1)已知常温下,Ksp[Fe(OH)3]=4.0×10-38,在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:Fe 3++3HCO3-=Fe(OH)3↓+3CO2↑;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为4.0×10-8mol•L-1
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表
上述盐溶液中的阴离子,结合H+能力最强的是CO32-.根据表中数据,浓度均为0.01mol•L-1
的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(3)下列说法不正确的是AD(填序号)
A.某温度下纯水中的c(H+)=10-6,故显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下,pH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小.
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(3)下列说法不正确的是AD(填序号)
A.某温度下纯水中的c(H+)=10-6,故显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下,pH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小.
3.有关硫及其化合物说法正确的是( )
| A. | 有浓硫酸参与的反应都是氧化还原反应 | |
| B. | 硫在足量空气中燃烧生成大量SO3 | |
| C. | SO2能使酸性高锰酸钾溶液褪色,体现了漂白性 | |
| D. | 二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加 |
13.NA表示阿伏加德罗常数,下列各组物质在一定条件下充分反应后,生成气体物质的分子数可能大于或等于NA的是( )
| A. | 400mL10 mol•L-1的浓盐酸与足量的MnO2反应 | |
| B. | 2molCu与200g98%的浓硫酸反应 | |
| C. | 65gZn与足量的硝酸反应 | |
| D. | H2O(g)和CO2混合气体2mol与足量的Na2O反应 |